
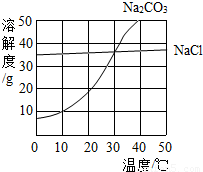
 如图,为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.
如图,为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:初中化学 来源: 题型:阅读理解
 (2013?克拉玛依二模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图)的溶液,他们对此产生了兴趣.
(2013?克拉玛依二模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图)的溶液,他们对此产生了兴趣.| 方法 | 实验操作 | 实验现象 | 实验结论 |
| 一 | 取少量样品于试管中,慢慢滴加BaCl2溶液,静置一段时间,倾去上层清液,向沉淀中继续滴加稀盐酸 | 先出现白色沉淀,后产生大量气泡 | 该瓶无色溶液是 Na2CO3 Na2CO3 . |
| 二 | 取该瓶溶液,慢慢滴加 盐酸 盐酸 溶液 |
产生气泡 | 该瓶无色溶液是Na2CO3.反应的化学方程式是 2HCl+Na2CO3═2NaCl+CO2↑+H2O 2HCl+Na2CO3═2NaCl+CO2↑+H2O . |
| 三 | 取少量样品于试管中,慢慢滴加MgSO4溶液 | 产生 白色沉淀 白色沉淀 |
该瓶无色溶液是 Na2CO3. |
| 经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐. | |||
| 四 | 取少量样品于试管中,滴加滴加2至3滴酚酞 取少量样品于试管中,滴加滴加2至3滴酚酞 |
溶液变红 | 该瓶无色溶液是 Na2CO3. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
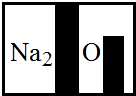 (2013?信阳一模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示)的溶液,他们对此产生了兴趣.
(2013?信阳一模)某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示)的溶液,他们对此产生了兴趣.| 实验操作 | 实验现象 |
| (1)取少量样品于试管中,慢慢滴加BaCl2溶液 | 出现白色沉淀 |
| (2)静置一段时间后,倾去上层清液,向沉淀中继续滴加稀盐酸 | 白色沉淀全部溶解,产生大量气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |

查看答案和解析>>
科目:初中化学 来源:2013年江苏省扬州中学树人学校中考化学一模试卷(解析版) 题型:填空题
| 物质 | NaCl | NH4CO3 | NH4Cl | NaHCO3 |
| 溶解度 | 36.0 | 21.6 | 37.2 | 9.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com