
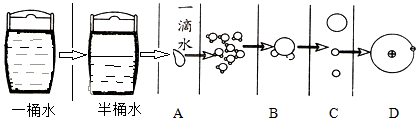
| A. | A | B. | B | C. | C | D. | D |
科目:初中化学 来源: 题型:选择题
| A. |  | B. | 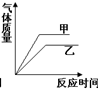 | C. |  | D. |  |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 空气 | NH3 | CH4 | HCl | O2 | |
| 密度/g•L-1 | 1.293 | 0.771 | 0.717 | 1.629 | 1.43 |
| 溶解性 | ---- | 极易溶 | 难溶 | 极易溶 | 难溶 |
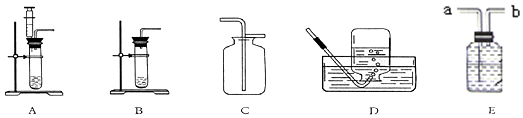
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
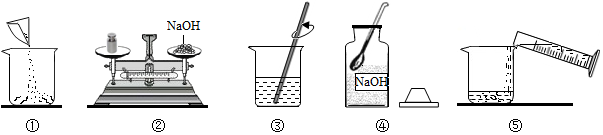
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
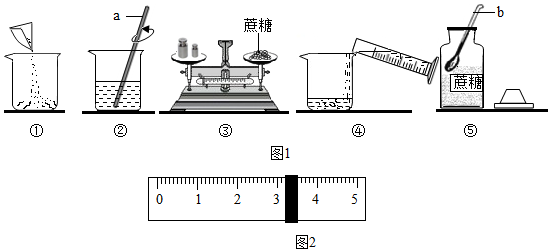
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 两种白色固体 | 主要操作、现象和结论 |
| 碳酸钙、氧化钙 | 分别将两种固体加水溶解,难溶于水的是碳酸钙,与水剧烈反应且有热量放出的是氧化钙 |
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 | Na2CO3 |
| 溶解度/g | 36.0 | 21.0 | 37.2 | 9.6 | 21.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com