
【题目】(1)如图所示试剂瓶中分别盛有四种常见的化学药品。
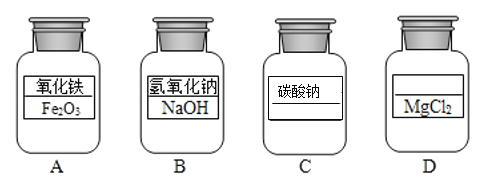
①C 瓶中药品的化学式为_____;
②D瓶中药品的名称是_____。
(2)用适当的数字和化学用语填空:
①2个氮分子_____;
②3个镁离子_____;
③能保持氢气化学性质的粒子_____;
④氯酸钾中氯元素显+5价_____。
【答案】Na2CO3 氯化镁 2N2 3Mg2+ H2 ![]()
【解析】
(1)①“某酸某”类化合物一般由金属和酸根组成,碳酸钠的化学式为:Na2CO3;D瓶中药品的名称是氯化镁。
(2)①分子式的前面加上数字表示分子的个数,2个氮分子表示为2N2。
②根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,因此三个镁离子表示为3Mg2+。
③能保持氢气化学性质的粒子是氢分子,故化学式为H2。
④根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,因此氯酸钾中氯元素显+5价表示为![]() 。
。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:初中化学 来源: 题型:
【题目】在点燃条件下,A和B反应生成C和D.反应前后分子变化的微观示意图如图所示.
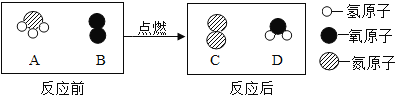
请回答以下问题:
(1)1个B分子中含有_____个原子.
(2)A中氮元素和氢元素的质量比为_____.
(3)四种物质中,属于单质的是_____(填图中字母,下同),化合物的是_____.
(4)在该反应中,生成C和D的质量比为_____(计算结果用最简整数比表示).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】神六、神七载人飞船成功返航,标志着我国已跨入航天领域国际先进行列。
(1)在宇宙飞船上可以安装盛有Na2O2的装置,它的作用是与人呼出的二氧化碳反应生成碳酸钠与氧气,写出该反应的化学方程式:______。
(2)请你写出实验室只用一种物质制取氧气的化学方程式:______。
(3)若用双氧水制氧气,通常会含有少量水蒸气。请在下列仪器中选择适当的仪器,组成一套制取并收集干燥氧气的装置(图中盛浓H2SO4的洗气瓶可以干燥气体),各仪器从左到右的接口顺序是_________(填各仪器接口处的字母)。该反应的方程式为:_____。
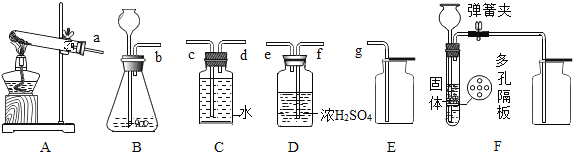
(4)证明集气瓶中的氧气已经收集满的方法是______。
(5)要测定生成的氧气的体积,必须选用除上图以外的仪器是______(填仪器名称)。
(6)F装置可用于实验室制取CO2,F相对于B装置的优点是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图所示,是细铁丝、硫粉、木炭在氧气中燃烧的实验示意图,请回答:

(1)实验Ⅰ中,可观察到细铁丝在氧气中燃烧的现象是:①剧烈燃烧、火星四射;②放出热量;③生成了一种黑色固体。其中能证明细铁丝燃烧属于化学变化的是______(填①或②或③)集气瓶装少量水的作用是___________。实验前,要将细铁丝盘成螺旋状,其目的是_________。某同学在该实验过程中,没有观察到铁丝燃烧,可能的原因有______(填标号)。
A 铁丝太粗 B 铁丝没有绕成螺旋状
C 集气瓶中氧气的浓度太低 D 点燃系在铁丝上的火柴后,太早伸入集气瓶中
(2)实验Ⅱ中,所用硫粉颜色为______色(填“白”或“黄”或“蓝”)集气瓶中装少量水的作用是______。
(3)实验Ⅲ中,可观察到木炭在氧气中燃烧发出白光,而木炭在空气中燃烧发出微弱的红光,这说明,物质燃烧的剧烈程度与氧气的______有关。
(4)写出实验中反应的文字表达式。
Ⅰ____________________
Ⅱ____________________
Ⅲ_______________
这三个反应的共同点是_____________(写1条)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图,下列说法正确的是()
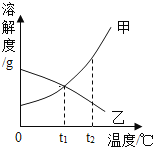
A. ![]() 时,甲、乙两种物质溶液的溶解度相等
时,甲、乙两种物质溶液的溶解度相等
B. ![]() 时,乙物质饱和溶液降温到
时,乙物质饱和溶液降温到![]() ,溶质质量分数升高
,溶质质量分数升高
C. ![]() 时,甲、乙两种物质饱和溶液的溶质质量分数相等
时,甲、乙两种物质饱和溶液的溶质质量分数相等
D. ![]() 时,甲物质溶液的质量分数一定大于乙物质溶液的质量分数
时,甲物质溶液的质量分数一定大于乙物质溶液的质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下面是甲、乙实验小组完成的相关实验。
甲小组:利用下图装置研究燃烧条件(已知白磷的着火点为40℃)。
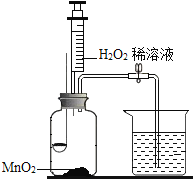
步骤Ⅰ:烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞。
步骤Ⅱ:用注射器向瓶内推入适量H2O2 溶液
(1)H2O2稀溶液与MnO2接触时发生反应的文字表达式为_____;
(2)实验中,推入H2O2溶液前,燃烧匙中的白磷不燃烧,原因是_____;推入H2O2溶液后,观察到烧杯中的现象是_____。
乙小组:哪些因素影响过氧化氢分解的速率?
实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
(1)通过实验对比可知,化学反应速率与浓度和温度有关系。
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子相互接触、碰撞的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:_____;
(3)用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,产生氧气的总重量_____(填“减小”或“不变”或“增大”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某品牌补铁剂主要成分是富马酸亚铁 (C4H2FeO4 ),富马酸亚铁有_____种元素组成,其摩尔质量是_____,该分子中各原子的个数比为_____,_____mol 的 C4H2FeO4 中约含有6.02×1023个氢原子。一个 C4H2FeO4 分子的质量(单位:克)的计算表达式是_____(列式即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学按照课本上的实验装置做“测定空气中氧气的体积分数”实验(如图1所示),但测出的氧气的体积分数明显小于1/5。请你参与探究:

(1)提出问题:造成误差的原因是什么?如何改进课本上的实验装置?
(2)查阅资料:①红磷的着火点是240/℃、白磷的着火点是40/℃(着火点是指可燃物在空气或氧气中燃烧所需要的最低温度)
②铜在空气中加热,能和氧气反应,生成黑色的氧化铜
(3)猜想与假设:①甲同学:可能是导管内原来含有空气,后来留有吸入的水,影响实验的准确性。
②乙同学:可能是瓶内残留气体中还有氧气。
③你还能作出的猜想是________________ 。
(4)交流与讨论:
①丙同学认为用木炭代替红磷,就可以消除误差,你认为他的猜想_____,(填“合理”或“不合理”)理由是_________________。
②他们对课本上的实验装置进行了如上图2所示的改进(其他仪器忽略)。
a 甲同学提出应把红磷换为白磷,理由是_______________。
b 通过粗铜丝来点燃玻璃管内的白磷,这利用了金属的_________性。
c 与课本上的实验装置相比较,该装置的优点是___________。(写一点)
(5)探究与反思:
①为了验证乙同学的猜想,将铜粉放在残余气体中加热,观察到铜粉变黑色,证明乙同学的猜想________________(填“正确”或“不正确”),写出铜和氧气反应的文字表达式_______________。
②大家用改进的图2装置进行实验,在实验的过程中,左侧玻璃管内的液面变化情况是__________, 最终升到1格处,得到较准确的结果。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一种自加热食品包装中加热包的成分有:生石灰、活性炭、铝粉、铁粉、碳酸钠、氯化钙、硫酸镁。使用时需向加热包加水,课堂上老师分别取适量加热包中的固体样品进行如图实验:
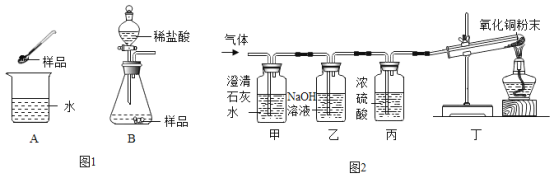
(1)实验A中,将样品加入水里触摸烧杯外壁发烫,其原因是_______。(用化学方程式表示)
(2)实验B中将一定量稀盐酸加入锥形瓶中,剧烈反应生成大量气体,学习小组同学对气体成分和锥形瓶内溶液进行探究。
I、对气体成分进行探究。
(作出假设)假设一:只有H2,假设二:只有CO2,假设三:H2和CO2。
(实验验证)小明同学设计如下实验,对气体成分进行探究。
①当气体通过甲时,澄清石灰水变浑浊,证明假设______不成立。
②丁中出现_______的现象时,证明假设三成立。
③乙的作用是_____。
II、对锥形瓶内的溶液进行探究。
实验后,小萍同学取少量锥形瓶内的溶液于试管中,向其中滴加NaOH溶液,开始一段时间无沉淀生成,其原因是锥形瓶内的溶液中存在______。
(总结反思)通过以上探究,小林同学做了如下的反思归纳:
a.加热包应密封防潮保存
b.向用过的加热包内的固体中加入过量稀盐酸后,过滤可以回收活性炭
c.能与水混合放出热量的物质,均可用作加热包中的发热材料
你认为其中不正确的是_____(填字母)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com