
分析 一壶水烧开了,壶盖被顶开,这是因为水分子间隔变大;硬水是指含有较多钙镁离子的水,软水是指不含或含有较少钙镁离子的水.区分硬水和软水的方法是:用肥皂水,加入肥皂水,泡沫多的是软水,泡沫少的是硬水;降低水的硬度的方法是:在生活中是加热煮沸,在实验室中是蒸馏.农业和园林浇灌植物时,将大水漫灌改为喷灌、滴灌的目的是节约水资源.
解答 解:(1)一壶水烧开了,壶盖被顶开,这是因为水分子间隔变大;故答案为:水分子间隔变大
(2)区分硬水和软水的方法是:用肥皂水,加入肥皂水,泡沫多的是软水,泡沫少的是硬水;降低水的硬度的方法是:在生活中是加热煮沸,在实验室中是蒸馏;故答案为:①肥皂水;②煮沸
(3)农业和园林浇灌植物时,将大水漫灌改为喷灌、滴灌的目的是节约水资源,故答案为:节约水资源
点评 本考点属于结合课本知识的信息,也体现了性质决定用途,用途反映性质的理念.还结合了新课标中的一个新的考点硬水与软水的区分,一定要加强记忆,综合应用.本考点主要出现在填空题和选择题中.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | Na2CO3、H2S04、NaCl、CaCl2 | B. | Na2CO3、BaCl2、K2S04、KN03 | ||
| C. | HCl、K0H、CaCl2、NaN03 | D. | MgS04、Na0H、HCl、CuSO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 碱性溶液能使酚酞试液变红,滴入酚酞试液后变红的溶液一定呈碱性 | |
| B. | 燃烧都伴随着发光、放热,所以有发光、放热现象的就是燃烧 | |
| C. | 在紫色的石蕊溶液中通入二氧化碳气体,溶液变红,说明二氧化碳气体显酸性 | |
| D. | 分子、原子都是不显电性的粒子,但不显电性的粒子不一定是分子或原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
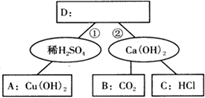 如图为酸碱的化学性质知识网络.A、B、C、D是四种常见的不同类别的无机物无机化合物,图中短线表示两种物质在一定条件下可以发生化学反应.请你据图回答.
如图为酸碱的化学性质知识网络.A、B、C、D是四种常见的不同类别的无机物无机化合物,图中短线表示两种物质在一定条件下可以发生化学反应.请你据图回答.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
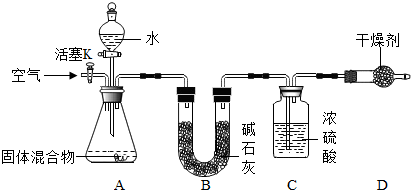
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com