
 漏斗活塞),请填写下列空白:
漏斗活塞),请填写下列空白:

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 铁、铝、铜是日常生活中使用最广泛的金属.
铁、铝、铜是日常生活中使用最广泛的金属.| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g?cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
| ||
| ||
| ||
| ||
| ||
| 64×2 |
| 64×2+32 |
| 64×2 |
| 64×2+32 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
(11分)铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是____
(填序号)。
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在
(2)常温下一些金属的物理性质数据如下:
| 金属单质 | 铜 | 铝 | 锌 | 铁 | 铅 |
| 导电性(以银的导电性为100作标准) | 99 | 61 | 27 | 17 | 7.9 |
| 密度/(g·cm-3) | 8.92 | 2.70 | 7.14 | 7.86 | 11.3 |
| 熔点/℃ | 1083 | 660 | 419 | 1535 | 328 |
| 硬度(以金刚石的硬度为10作标准) | 2.5~3 | 2~2.9 | 2.5 | 4~5 | 1.5 |
分析上述数据,碎石用的大锤常用铁制而不用铝制,原因是
_________________________________________________________。
(3)金属活动性顺序在运用中给我们三条判断依据,即在金属活动性顺序里:
⑴金属的位置越靠前它的活动性就越强;
⑵位于氢前面的金属能置换出盐酸、稀硫酸中的氢;
⑶位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
通过查阅资料我发现金属铝与氧化铜在高温条件下能发生置换反应,其化学方程式为 ,由此我发现了一条新的判断依据 。
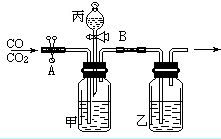
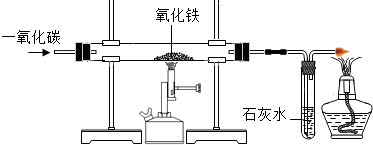
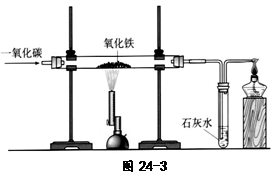 (4)炼铁的原理是利用一氧化碳与氧
(4)炼铁的原理是利用一氧化碳与氧
化铁反应。在实验室里,可用右图
所示装置进行实验:实验中玻璃管内
的粉末由红色变为 色,该反
应的化学方程式为 ,通过实
验我可以得出的一氧化碳的相关
化学性质是 。
(5)工业上火法炼铜的一个主要反应是 Cu2S+ O2  2Cu+ SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。
2Cu+ SO2 Cu2S中铜元素的质量分数为_______________ (写出算式)。
用500吨含Cu2S 80%的铜矿石,理论上可以炼出多少吨铜?(请写出详细的计算过程,分步给分,计算结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
归纳整理相关知识,构建知识网络是学习化学的一种重要的方法。
(1)右图是某同学构建的有关氧气的获取和性质的知识网
络图。请根据该图回答有关问题。
①电解水是实现转化a的![]() 途径之一,该反应的化学方程式是 。
途径之一,该反应的化学方程式是 。
②用转化c获得O2时,O2中会混有的少量杂质是 。
③在自然界中,CO2转化为O2的主要途径是绿色植物的 作用。
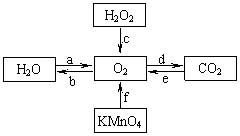 ④转化f可用于实验室制取O2,该反应的基本反应类型是 。
④转化f可用于实验室制取O2,该反应的基本反应类型是 。
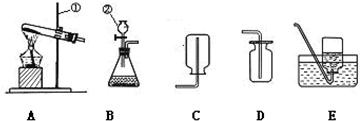
(2)水在化学实验中的作用不可忽视。下图中五个实验分别用到水。
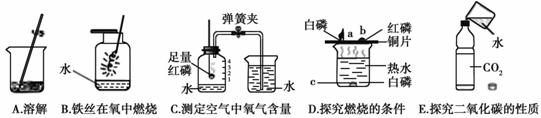
①实验A中水作 (填“溶剂”或“溶质”)。
②实验B中水的作用是防止集气瓶 。
③实验C通过烧杯中的水进入集气瓶中的体积可得出氧气约占空气总体积 的结论。
④实验D中水的作用是提供热量和 。
⑤实验E中的水作 。
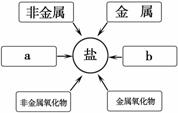
(3)甲同学通过查阅资料,发现许多反应都有盐类物质生成。
他将这些知识间相互关系整理成右图,请将右图补充完整。
a ,b 。
(4)乙同学提出可用右图指导进行物质的制备。请写出2个有关硫酸亚铁生成的化学方程式。
答: ;
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com