
 质量守恒定律对科学发展具有重大意义.
质量守恒定律对科学发展具有重大意义. ”和“
”和“ ”分别表示不同的原子)
”分别表示不同的原子) ”微粒.
”微粒.| 物质 | A | B | C | D |  |
微观示意图 |  |  |  | ||
| 反应前质量/g | 100 | 1 | 1 | 46 | |
| 反应后质量/g | 4 | 89 | 55 | X |
 微粒,现已有了6个,应再添加2个
微粒,现已有了6个,应再添加2个 .
.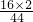 +54g×
+54g×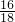 =112g>96g,可确定生成物中的一部分氧元素来自D,即D中一定含有氧元素,D中碳、氢、氧三元素的原子个数比为:
=112g>96g,可确定生成物中的一部分氧元素来自D,即D中一定含有氧元素,D中碳、氢、氧三元素的原子个数比为: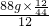 :
: :
: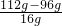 =2:6:1,故D的化学式为C2H6O,该反应的化学方程式为:C2H6O+3O2
=2:6:1,故D的化学式为C2H6O,该反应的化学方程式为:C2H6O+3O2 2CO2+3H2O.
2CO2+3H2O. 2CO2+3H2O.
2CO2+3H2O.

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
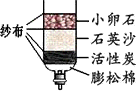 2010年,云南省遭遇了百年一遇的旱情,给工农业生产和生活用水带来了严重困难.为缓解旱情,有关部门实施了人工降雨.李斌同学利用所学知识将浑浊的水用右图所示的简易净水器进行净化,请根据你掌握的知识回答:
2010年,云南省遭遇了百年一遇的旱情,给工农业生产和生活用水带来了严重困难.为缓解旱情,有关部门实施了人工降雨.李斌同学利用所学知识将浑浊的水用右图所示的简易净水器进行净化,请根据你掌握的知识回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
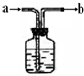 如图是化学实验中常被称为“万能瓶”的装置.
如图是化学实验中常被称为“万能瓶”的装置.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
 2P2O5
2P2O5查看答案和解析>>
科目:初中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com