
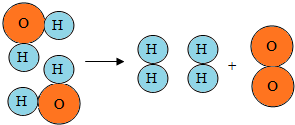
 你能根据下面列出的水通电生成氢气和氧气的微粒变化示意图,说一说分子和原子在化学反应中是怎样变化的吗?
你能根据下面列出的水通电生成氢气和氧气的微粒变化示意图,说一说分子和原子在化学反应中是怎样变化的吗?  备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:选择题
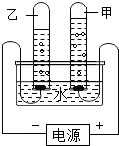 下列关于电解水实验的叙述正确的是( )
下列关于电解水实验的叙述正确的是( )| A. | 实验说明水是由氢原子和氧原子组成的 | |
| B. | 乙试管内产生的气体在点燃之前不需要检验纯度 | |
| C. | 甲试管内产生的气体能使带火星的木条复燃 | |
| D. | 甲、乙两试管产生的气体质量之比为1:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$ 2Fe2O3 | B. | C+FeO $\frac{\underline{\;高温\;}}{\;}$Fe+CO2↑ | ||
| C. | 2H2O═2H2↑+O2↑ | D. | CuO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
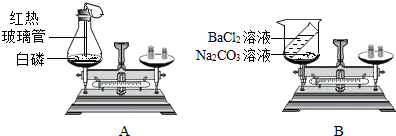
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 小于(a+b)g | B. | 等于(a+b)g | C. | 不大于(a+b)g | D. | 不小于(a+b)g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | m+n+a | B. | m-n-a | C. | m+n-a | D. | a-m-n |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com