
 Cu+H2O
Cu+H2O
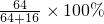 =6.4g
=6.4g ×100%=84%
×100%=84%

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:初中化学 来源: 题型:
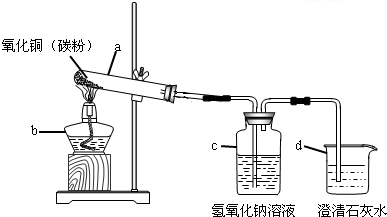
| 装置 | 反应前 | 反应后 |
| a | 试管的质量36.2g 氧化铜和炭粉混合物的质量为20.0g |
试管和固体物质的质量为54.8g |
| c | 反应后瓶内液体比反应前增重1.1g | |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
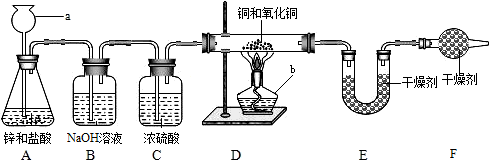
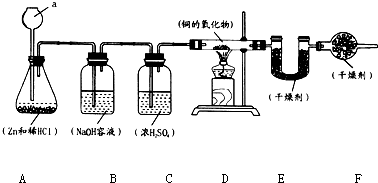 实验室用锌和稀盐酸制取氢气,并用氢气还原铜的一种氧化物的实验来测定该氧化物的组成.实验装置如图所示:
实验室用锌和稀盐酸制取氢气,并用氢气还原铜的一种氧化物的实验来测定该氧化物的组成.实验装置如图所示:7.2g-0.9g×
| ||
0.9g×
|
7.2g-0.9g×
| ||
0.9g×
|
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com