2Cu+O
2
2CuO 化合反应 2KMnO
4 
K
2MnO
4+MnO
2+O
2↑ 分解反应 2NaOH+CuSO
4=Cu(OH)
2↓+Na
2SO
4 2H
2O
2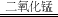
2H
2O+O
2↑ 放热 2NH
4Cl+Ca(OH)
2=CaCl
2+2H
2O+2NH
3↑
分析:(1)加热铜丝,知反应物为两种,生成物为一种;又因为由两种或两种以上的物质生成一种新物质的反应为化合反应;可简记为A+B=AB,故可知加热铜丝的反应类型;
(2)加热高锰酸钾制取氧气,知反应物为一种,生成物为多种;又因为:一种化合物在特定条件下(如加热,通直流电,催化剂等)分解成二种或二种以上较简单的单质或化合物的反应为分解反应;简记为AB=A+B;故可知加热高锰酸钾制取氧气的反应类型;
(3)①氢氧化钠溶液与硫酸铜溶液反应:可知反应物,此反应为两种化合物反应,是复分解反应,利用“内项结合,外项结合”故可书写生成物的化学式,从而配平化学方程式;
②实验室用双氧水制取氧气,可知反应物双氧水、生成物水与氧气、反应条件二氧化锰作催化剂,根据质量守恒定律,可以书写化学方程式,该反应为放热反应;
(4)氯化铵和氢氧化钙固体混合研磨生成氯化钙和水,同时生成一种氨臭味的气体:可知反应物、生成物中有氨气生成、反应条件,书写化学方程式.
解答:(1)加热铜丝,知反应物铜和氧气、生成物氧化铜、反应条件加热,故书写化学方程式2Cu+O
2
2CuO;反应符合A+B=AB,即“多变一”,为化合反应;
(2)加热高锰酸钾制取氧气,知反应物为高锰酸钾,生成物为K
2MnO
4、MnO
2、O
2;反应符合AB=A+B,即“一变多”,为分解反应;
(3)①氢氧化钠溶液与硫酸铜溶液反应:知反应物NaOH、CuSO
4,此反应为两种化合物反应,是复分解反应,利用“内项结合,外项结合”,故可书写生成物的化学式Cu(OH)
2、Na
2SO
4,故书写化学方程式2NaOH+CuSO
4=Cu(OH)
2↓+Na
2SO
4;
②实验室用双氧水制取氧气,则可知反应物为H
2O
2、生成物为H
2O、O
2、反应条件为二氧化锰作催化剂,故可书写化学方程式为2H
2O
2 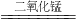
2H
2O+O
2↑;该反应为放热反应;
(4)氯化铵和氢氧化钙固体混合研磨生成氯化钙和水,同时生成一种氨臭味的气体:可知反应物NH
4Cl、Ca(OH)
2,生成物中有氨气生成、CaCl
2、H
2O,故可书写化学方程式2NH
4Cl+Ca(OH)
2=CaCl
2+2H
2O+2NH
3↑.
故答为:(1)2Cu+O
2
2CuO;化合反应; (2)2KMnO
4
K
2MnO
4+MnO
2+O
2↑;分解反应;
(3)①2NaOH+CuSO
4=Cu(OH)
2↓+Na
2SO
4; ②2H
2O
2 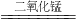
2H
2O+O
2↑;放热
(4)2NH
4Cl+Ca(OH)
2=CaCl
2+2H
2O+2NH
3↑;
点评:根据题目信息,找出反应物和生成物,再利用书写化学方程式的方法及步骤,根据质量守恒定律,正确书写化学方程式;学会判定反应类型的方法.

 2CuO 化合反应 2KMnO4
2CuO 化合反应 2KMnO4  K2MnO4+MnO2+O2↑ 分解反应 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 2H2O2
K2MnO4+MnO2+O2↑ 分解反应 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 2H2O2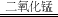 2H2O+O2↑ 放热 2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑
2H2O+O2↑ 放热 2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑ 2CuO;反应符合A+B=AB,即“多变一”,为化合反应;
2CuO;反应符合A+B=AB,即“多变一”,为化合反应;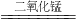 2H2O+O2↑;该反应为放热反应;
2H2O+O2↑;该反应为放热反应; 2CuO;化合反应; (2)2KMnO4
2CuO;化合反应; (2)2KMnO4 K2MnO4+MnO2+O2↑;分解反应;
K2MnO4+MnO2+O2↑;分解反应;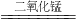 2H2O+O2↑;放热
2H2O+O2↑;放热