
右图是氢氧化钙和盐酸反应的微观模拟图。请回答下列问题:
(1)该反应的化学方程式为:
 ;
;
(2)请将反应后的相关粒子图形补充完整;
(3)结合图示从微观角度解释中和反应的实质是:
。
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
节约资源和保护环境已经成为我们的基本国策。节能减排、环境保护和生态市建设是市政府近些年的工作重点。硫酸厂生产硫酸的流程是:把含硫矿物燃烧,生成二氧化硫,二氧化硫和氧气在高温和催化剂的作用生成三氧化硫,最后三氧化硫和水化合生成硫酸。写出三氧化硫和水化合生成硫酸的化学方程式
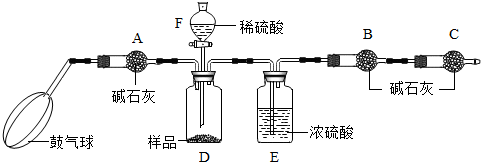
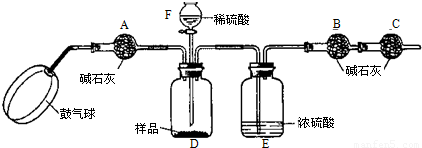
某纯碱样品中含有少量硫酸钠,现欲测定其碳酸钠的质量分数,利用含有少量硫酸的澄清废水进行如下实验:
《实验原理》Na2CO3+H2SO4= Na2SO4 + H2O + CO2↑通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
《实验装置》

《实验步骤》
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端。)
③按动鼓气球,持续鼓入空气约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)
⑧计算。
⑴已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用是: ,以免使测定结果偏大。
(2) (能或不能)用稀盐酸代替稀硫酸,因为盐酸具有 性,会使测得碳酸钠的质量分数 (填偏大、偏小或不变,下同);若去除干燥管C,则测得碳酸钠的质量分数将会
(3)E装置的作用是
(4)本实验能否省略③、⑥两个步骤? (填能或不能),原因分别是 、
(5)若所取样品的质量为6g,分液漏斗F中盛放5%只含硫酸一种溶质的澄清废水,称得m1为51.20g,m2为53.40g,(计算结果保留两位小数)
求:(1)样品中碳酸钠的质量分数为多少?
(2)D装置中正好反应后,所得溶液的溶质质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
右图是氢氧化钙和盐酸反应的微观模拟图。请回答下列问题:
(1)该反应的化学方程式为:
;
(2)请将反应后的相关粒子图形补充完整;
(3)结合图示从微观角度解释中和反应的实质是:
 。
。
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省镇江市丹阳市实验初中九年级(下)第一次素质调研化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com