
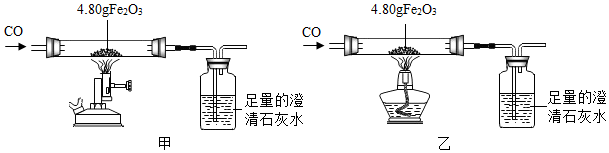
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 称量黑色粉末质量/g | m1 | m2 |
| 2 | 取黑色粉末,用磁铁吸引 | 能被吸引 | 能被吸引 |
| 3 | 取黑色粉未,加入稀盐酸 | 全部溶解,有大量气泡 | 无明显现象 |
| 4 | 取黑色粉末,加入足量CuSO4溶液 | 有红色物质生成 | 无明显现象 |
分析 (1)根据一氧化碳是有毒的气体,需要进行尾气处理,据此解答;
(2)①根据铁能被磁铁吸附,能与盐酸反应的性质分析回答;
②根据乙组生成物与酸反应的现象分析成分,根据化学式计算,验证分析推断;
(3)根据实验的结果分析结论.
解答 解:
(1)一氧化碳是有毒的气体,排放到空气中会污染空气,利用一氧化碳的可燃性可在导管后放点燃的酒精灯处理一氧化碳或在导管后扎气球收集一氧化碳,可以防止污染空气;
(2)①在甲中,黑色粉末全部能被磁铁吸引,能全部与盐酸反应有气泡,加入足量CuSO4溶液,有红色物质生成可知,甲组的固体产物是Fe,产生气泡的化学方程式为:Fe+2HCl═FeCl2+H2↑.
②一氧化碳和氧化铁反应的固体产物为黑色,可能是铁粉、四氧化三铁或二者的混合物,在乙组中,生成物能被磁铁吸引,取黑色粉末加入盐酸,乙组观察到黑色固体溶解,无气泡,取黑色粉末,加入足量CuSO4溶液,无明显现象,说明没有铁粉的产生,说明生成物是四氧化三铁,m2=4.8g×$\frac{56×2}{56×2+16×3}$$÷\frac{56×3}{56×3+16×4}$×100%=4.64g;
(3)甲、乙两组实验说明温度对CO和Fe2O3反应影响,且均体现出CO的还原性.
故答案为;
(1)导管后放点燃的酒精灯或在导管后扎气球;
(2)①Fe+2HCl═FeCl2+H2↑;②4.64;
(3)还原性
点评 本题考查的是一氧化碳还原氧化铁实验以及实验的注意事项,完成此题,可以依据已有的物质的性质进行.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:初中化学 来源: 题型:选择题
| A. | 0.30g | B. | 0.20g | C. | 0.15g | D. | 0.45g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Ag | B. | Ag 和 Zn | C. | Cu 和 Ag | D. | Cu、Zn 和 Ag |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
| 名称 | 质量/g | ||
| ① | 碳酸氢钠 | 0、10 | V1 |
| ② | 碳酸钠 | 0、10 | V2 |
| ③ | 白色粉末 | x | V1 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 项目和次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
| 样品溶液质量(g) | 10 | 20 | 30 | 40 |
| 氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
| 产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com