
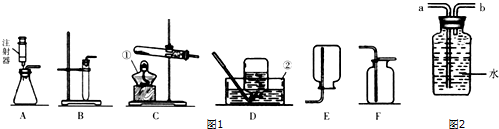
分析 (1)了解常用的仪器名称、用法、选取和连接方法;
(2)用装置C制氧气,需要加热,则用高锰酸钾或氯酸钾制取氧气;掌握试管口略向下倾斜的原因;
(3)实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应加热引起发生装置炸裂.能控制反应速率的为A装置;乙炔微溶于水且密度比空气的小,可选择收集装置.
解答 解:(1)熟记常用仪器:①酒精灯;②水槽;
(2)写出用装置C制氧气的反应的化学方程式:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;该装置中试管口略向下倾斜的原因是:防止加热时冷凝水倒流引起试管炸裂;欲收集干燥的该气体,因氧气的密度比空气都是,可选用的装置是F;
(3)实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应加热引起发生装置炸裂.能控制反应速率的为A装置;乙炔微溶于水且密度比空气的小,如果用图所示装置收集乙炔,气体应从b端管口通入.
故答案为:
(1)①酒精灯;②水槽;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;防止冷凝水倒流回热的试管底部使试管爆裂;F;
(3)A;b.
点评 本题主要考查了实验室制取氧气的注意事项及根据常用气体的密度和水溶性,选择的收集方法;根据题目中的信息正确书写化学方程式.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 中和反应生成盐和水,则生成盐和水的反应一定是中和反应 | |
| B. | 酸的溶液显酸性,则碱的溶液显碱性 | |
| C. | 氢氧化钠溶液可以和CO2反应,则氢氧化钠溶液也可以和CO反应 | |
| D. | 复分解反应的条件是要有沉淀、气体、水生成,则有气体、沉淀、水生成的反应一定是复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 |
| 剪下一片变黑的铜片,放入试管中,加入足量的稀硫酸 | 铜片表面的黑色物质全部消失,露出红色的铜,溶液变为蓝色. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com