
【题目】(1)下表是CO2气体在水中的几组溶解度数据(单位:mL/100mL水)
溶解度 温度(℃) 大气压 | 0 | 25 | 50 | 75 | 100 |
1 | 1.79 | 0.752 | 0.423 | 0.307 | 0.231 |
10 | 15.92 | 7.14 | 4.095 | 2.99 | 2.28 |
25 | 29.30 | 16.20 | 9.71 | 6.82 | 5.73 |
①根据CO2的溶解度表,可以得出气体的溶解度随外界条件的变化规律是:__________、____。
②打开可乐瓶有气体逸出,说明原瓶中的压强_________(填“>”、“<”或“=”)瓶外大气压强。
(2)甲、乙两物质(均不含结晶水)的溶解度曲线如下图,请回答
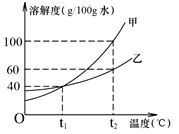
① t2℃时,甲、乙两物质溶解度较大的是___________。
② t1℃时,50g水中加入30g乙,充分溶解所得溶液的质量是___________g。
③ t2℃时,将乙的不饱和溶液转化为饱和溶液一定可行的方法 是___________(填编号)。
A.加足量溶质乙 B.蒸发溶剂至晶体析出 C.降温
④ t2℃时,甲、乙溶液的溶质质量分数相等且均为a%,则甲溶液一定为__________(填“饱和”或“不饱和”)溶液,a%的取值范围为___________。
⑤ 将t2℃等质量的甲、乙饱和溶液分别降温到t1℃,有关说法正确的是___________。
A.t1℃时溶质质量:甲=乙 B.t1℃时溶剂质量:甲>乙
C.t1℃时溶液质量:甲<乙 D.析出晶体质量:甲>乙
【答案】 压强相同时气体的溶解度随温度升高而减小 温度相同时气体溶解度随压强的增大而增大 > 甲 70 AB 不饱和 0<a%≤37.5% CD
【解析】(1)①由题目中提供的数据可知,影响CO2的溶解度的因素是温度与压强,即温度升高,气体的溶解度减小;压强增大,气体的溶解度增大;压强相同时气体的溶解度随温度升高而减小;②打开可乐瓶有气体溢出,说明压强减小了,二氧化碳在水中的溶解度变小,从水中逸出,说明原瓶中的压强大于瓶外大气压强;(2)①由甲、乙两种物质的溶解度曲线可知,t2℃时,甲、乙两种物质溶解度较大的是甲;②由乙物质的溶解度曲线可知,t1℃时,乙物质的溶解度是40g,t1℃时,50g水中放入30g乙,只能溶解20g,充分溶解后所得溶液的质量是50g+20g=70g;③③由图示信息可知t2℃时,将乙的不饱和溶液转化为饱和溶液一定可行的方法是:加足量溶质乙;蒸发溶剂至晶体析出;④由甲、乙两种物质的溶解度曲线可知,t2℃时,甲的溶解度大于乙,乙的溶解度是60g,甲、乙溶液的溶质质量分数相等均为a%,其中一定是不饱和溶液的是甲,a%的取值范围是不大于t2℃时乙的饱和溶液的质量分数,即: ![]() ;⑤A、由上述分析可知,将t2℃等质量的甲、乙溶液分别降温到t1℃,甲的溶解度受温度的影响较大,甲析出固体的质量多,t1℃时溶质质量:甲<乙,错误; B、将t2℃等质量的甲、乙溶液分别降温到t1℃,甲析出固体的质量多,t1℃时溶剂质量:甲<乙,错误;C、将t2℃等质量的甲、乙溶液分别降温到t1℃,甲析出固体的质量多,t1℃时溶剂质量:甲<乙,t1℃时溶质质量:甲<乙,故t1℃时溶液质量:甲<乙,正确;D、由上述分析可知,将t2℃等质量的甲、乙溶液分别降温到t1℃,析出晶体质量:甲>乙。正确。
;⑤A、由上述分析可知,将t2℃等质量的甲、乙溶液分别降温到t1℃,甲的溶解度受温度的影响较大,甲析出固体的质量多,t1℃时溶质质量:甲<乙,错误; B、将t2℃等质量的甲、乙溶液分别降温到t1℃,甲析出固体的质量多,t1℃时溶剂质量:甲<乙,错误;C、将t2℃等质量的甲、乙溶液分别降温到t1℃,甲析出固体的质量多,t1℃时溶剂质量:甲<乙,t1℃时溶质质量:甲<乙,故t1℃时溶液质量:甲<乙,正确;D、由上述分析可知,将t2℃等质量的甲、乙溶液分别降温到t1℃,析出晶体质量:甲>乙。正确。


科目:初中化学 来源: 题型:
【题目】氢能是理想的清洁能源。以太阳能为热源,经由铁氧化合物循环分解水的过程如下:
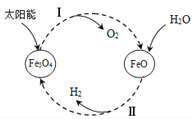
(1)反应Ⅰ的基本反应类型为_____________。
(2)写出在一定条件下发生的反应Ⅱ的化学方程式_______________。
(3)在上述循环过程中,最终得到的产品是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】烟气脱硫工艺可实现消除SO2的同时生产新产品(如CaSO4),实现“绿色化学”生产。主要生产流程如下:
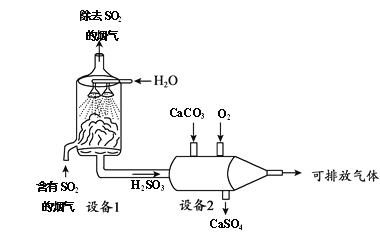
(1)设备1中,通过喷水除去烟气中的SO2,该反应的化学方程式为____________。
(2)设备2中,发生的化学反应之一为:2CaSO3+O2==2CaSO4,此反应属于基本类型中的__________________反应。
(3)此生产流程制得的CaSO4中硫元素的化合价为_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】汽车尾气净化装置中装有铂催化剂,尾气在催化剂表面反应的微观过程可用下图表示。下列有关说法正确的是
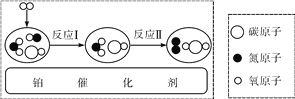
A. 反应Ⅰ中的反应物分子有三种
B. 反应Ⅰ属于分解反应
C. 反应Ⅱ中参加反应的二氧化氮与一氧化碳的分子个数比为1∶2
D. 此净化装置无法消除尾气中一氧化氮对空气的污染
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向1molFe2O3中通入CO并加热,随着CO的通入,有关量的变化如下图,分析正确的是
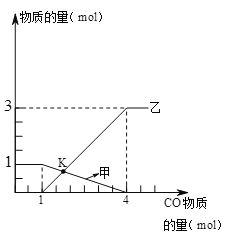
A. 曲线甲表示生成铁物质的量 B. 曲线乙表示氧化铁物质的量
C. K点时生成铁与剩余氧化铁物质的量相等 D. K点时固体中铁元素物质的量是2mol
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学利用石灰石和稀盐酸进行如下实验,操作过程和数据如图(样品中杂质不与酸反应也不溶于水)。
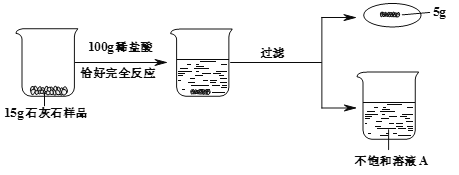
(1)15g石灰石样品中CaCO3物质的量。
(2)列式计算不饱和溶液A的溶质质量分数(结果准确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】微观示意图有助于我们认识化学物质和理解化学反应。
甲是一种比较清洁的燃料,已知甲和乙能在一定条件下反应生成丙和丁。
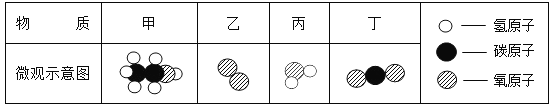
(1)甲、乙、丙、丁中属于单质的是__________(填序号)。
(2)甲中碳、氢、氧元素的质量比为__________。
(3)在化学反应前后,可能变化的是 __________(填序号)。
a. 原子种类 b. 原子数目 c. 分子数目 d. 元素种类
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在人们担心化石能源将被耗尽的时候,科学家发现海底埋藏着大量可燃烧的“冰”——“可燃冰”,其中主要含有甲烷水合物,可燃冰将成为未来新能源,但在开采技术上还存在着困难,2017年我国在可燃冰开采技术上有了较大突破。

(1)写出CH4燃烧的化学方程式________________________________。
(2)可燃冰作为未来新能源,与煤、石油相比其优点是________。(答一点即可)
(3)天然气作为家用燃枓,有时燃气灶的火焰出现黄色或橙色,锅底出现黑色,为避免这种现象的发生,你将如何操作?_______________________
【答案】 CH4+2O2![]() CO2+2H2O 污染小(或热值大等) 调大燃气灶的进风口等(合理即可)
CO2+2H2O 污染小(或热值大等) 调大燃气灶的进风口等(合理即可)
【解析】(1)根据甲烷燃烧生成二氧化碳和水及化学方程式的书写方法解答;
(2)根据可燃冰是一种比较理想的燃料分析解答;
(3)根据增大氧气的浓度或增大可燃物与氧气的接触面积,可以促进燃烧分析解答。
解:(1)甲烷燃烧生成二氧化碳和水,反应的化学方程式为:CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
(2)可燃冰作为未来新能源,与煤、石油相比其优点是:同等条件下燃烧产生的热量比煤和石油多,燃烧后几乎不产生任何残渣和废气,故填:污染小(或热值大等);
(3)天然气作为家用燃枓,有时燃气灶的火焰出现黄色或橙色,锅底出现黑色,说明氧气不足,燃气燃烧不充分,此时,可将灶具的进风口调大,这样做的目的是增加进入的空气的量,使燃气燃烧更充分。
【题型】简答题
【结束】
13
【题目】氨气在化学工业中用途广泛。合成氨反应的微观过程如下图所示,请结合图示回答问题:

(1)图中的![]() 属于___________(填“单质”或“化合物”)。
属于___________(填“单质”或“化合物”)。
(2)该反应所属的化学反应基本类型是___________反应。
(3)根据物质变化的微观图示,可知化学反应前后肯定发生变化的是______(填序号)。
①元素的种类 ②原子的质量 ③分子的种类 ④原子的数目
(4)工业上常用氨气来处理有毒气体NO2,反应原理是8NH3+6NO2 ![]() 7X+12H2O,其中X的化学式是______________。
7X+12H2O,其中X的化学式是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲烷(化学式为CH4)不完全燃烧时生成水和其它氧化物。某实验小组对此展开研究:
①常用___________检验生成物中是否含有水②对燃烧产物中的其它氧化物进行探究:(图中固定试管的仪器已略去)
假设 | 实验 | 现象 | 结论 |
生成物中有一氧化碳 | 用下图装置进行实验
| A中的现象是 ________ | 生成物中含有一氧化碳。写出A中的反应化学方程式是______ |
进一步查阅资料,发现CO能溶于铜液(醋酸二氨合铜和氨水的混合液)。因此可在装置B后再连接下图装置D,其目的是______,装置B、D的连接顺序:导管C连接____(填“E”或“F”)。

实验小组通过装置B中石灰水变浑浊判断燃烧产物中一定含有二氧化碳,你觉得该实验小组的判断是否正确?若不正确,请设计简单实验判断燃烧产物中是否含有二氧化碳______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com