

分析 (1)根据碳酸钙和二氧化硅在高温的条件下生成硅酸钙和二氧化碳,碳酸钠和二氧化硅在高温的条件下反应生成硅酸钠和二氧化碳进行分析;
(2)根据氢氧化钠和二氧化硅反应生成硅酸钠和水进行分析;
(3)①根据二氧化硅和碳在高温的条件下反应生成硅和一氧化碳进行分析;
②根据氢气与氧气可能爆炸,则整个制备过程必须达到无水无氧进行分析;
③根据生产高纯硅的流程示意图可知,盐酸既是反应物,又是生成物进行分析.
解答 解:(1)碳酸钙和二氧化硅在高温的条件下生成硅酸钙和二氧化碳,碳酸钠和二氧化硅在高温的条件下反应生成硅酸钠和二氧化碳,化学方程式为:CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;
(2)氢氧化钠和二氧化硅反应生成硅酸钠和水,化学方程式为:2NaOH+SiO2=Na2Si03+H2O;
(3)①二氧化硅和碳在高温的条件下反应生成硅和一氧化碳,化学方程式为:Si02+2C$\frac{\underline{\;高温\;}}{\;}$Si+2C0↑;
②氢气与氧气可能爆炸,则整个制备过程必须达到无水无氧,所以在H2还原SiHCl3过程中混入02,可能引起的后果是:硅被氧化而得不到高纯硅,并且发生爆炸;
③由生产高纯硅的流程示意图可知,为了达到绿色化学和节约资源的目的,物质A需要循环使用,A的化学式是HCl.
故答案为:(1)CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;
(2)2NaOH+SiO2=Na2Si03+H2O;
(3)①Si02+2C$\frac{\underline{\;高温\;}}{\;}$Si+2C0↑;
②硅被氧化而得不到高纯硅,并且发生爆炸;
③HCl.
点评 了解分子、原子、离子、元素与物质之间的关系;掌握氧化物的概念、反应类型的判定方法;掌握质量守恒定律的内容及其应用.


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物 质 | 所含杂质 | 除 去 杂 质 的 方 法 |
| A | Cu | CuO | 加入过量的稀硫酸、过滤、洗涤、干燥 |
| B | N2 | O2 | 放入足量的红磷后点燃 |
| C | NaCl溶液 | NaOH | 加入适量稀盐酸,蒸发、结晶 |
| D | FeSO4 | CuSO4 | 先加水溶解,再加足量金属铁,过滤,洗涤,干燥 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
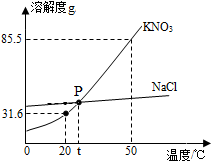 如图为NaCl和KNO3的溶解度曲线,请回答下列问题:
如图为NaCl和KNO3的溶解度曲线,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
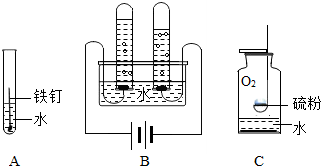 水是生命的源泉,下列变化都是与水相关,请根据A、B、C、D图示回答下列问题:
水是生命的源泉,下列变化都是与水相关,请根据A、B、C、D图示回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
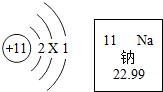 根据如图的有关信息判断,下列说法错误的是( )
根据如图的有关信息判断,下列说法错误的是( )| A. | 钠原子的核电荷数为11 | |
| B. | 钠的原子结构示意图中X=8 | |
| C. | 钠原子的相对原子质量为22.99 | |
| D. | 在化学反应中,钠原子容易得到1个电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验次数 | 稀盐酸用量(g) | 生成二氧化碳的质量(g) |
| 1 | 10 | 1.1 |
| 2 | 10 | 2.2 |
| 3 | 10 | 3.3 |
| 4 | 10 | 4.4 |
| 5 | 10 | 4.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 | 待分类组 |
 测定空气里氧气的含量 测定空气里氧气的含量 | 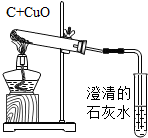 木炭还原氧化铜 木炭还原氧化铜 | 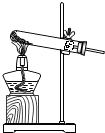 高锰酸钾制氧气 高锰酸钾制氧气 | 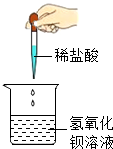 酸碱中和反应 酸碱中和反应 |  铁与硫酸铜溶液反应 铁与硫酸铜溶液反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
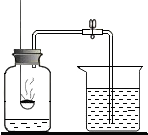
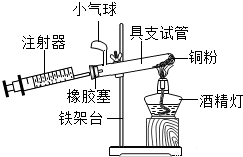 为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为50mL的具支试管作反应容器,将过量的铜粉放入试管,用橡皮塞塞紧具支试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如图的实验装置.请回答下列问题:
为测定空气中氧气的含量,小华同学打算设计如下方案:选用实际容积为50mL的具支试管作反应容器,将过量的铜粉放入试管,用橡皮塞塞紧具支试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如图的实验装置.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com