
【题目】(1)用适当的化学符号和数字回答:
①3个磷原子_____;
②保持氧气化学性质最小微粒_____;
③氧化铝中铝元素化合价_____;
④人体血红素中亚铁离子_____ ;
⑤温度计中常用的金属_____;
⑥常用作导线的金属_____。
(2)某同学写了以下化学方程式:
A 
B 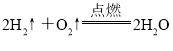
C ![]()
D 
E 
根据化学方程式错误的不同,将其序号填入以下相应的空白处:
①未配平的是_____;
②化学式写错的是_____;
③反应条件写错的是_____;
④未注明反应条件的是_____;
⑤“↑”使用不当的是_____。
【答案】3P O2 ![]() Fe2+ Hg Cu E A D C B
Fe2+ Hg Cu E A D C B
【解析】
(1)①3个磷原子表示为3P。
②氧气是由氧分子构成的,故保持氧气化学性质最小微粒氧分子,化学式为O2。
③氧化铝中铝元素化合价为+3价,表示为![]() 。
。
④人体血红素中亚铁离子表示为Fe2+。
⑤温度计中常用的金属是汞,化学式为Hg。
⑥常用作导线的金属是铜,化学式为Cu。
(2)A、氧化镁化学式书写错误,正确为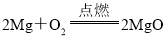 ;
;
B、反应物不打气标符号,正确为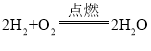 ;
;
C、铁在氧气中点燃生成四氧化三铁,正确为 ;
;
D、过氧化氢分解成水和氧气, ;
;
E、化学方程式配平错误,正确为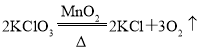 。
。
①未配平的是E;
②化学式写错的是A;
③反应条件写错的是D;
④未注明反应条件的是C;
⑤“↑”使用不当的是B。


 53天天练系列答案
53天天练系列答案科目:初中化学 来源: 题型:
【题目】蚊虫叮咬时,会分泌蚁酸.化学小组同学对蚁酸产生了浓厚的兴趣,决定对其进行探究.
[提出问题]蚁酸的成分是什么?它有什么性质?
[查阅资料]I蚁酸的化学名称叫甲酸,化学式为HCOOH
II蚁酸隔绝空气并加热时会分解生成两种氧化物
Ⅲ浓硫酸具有吸水性
[实验探究](1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成_____色,说明蚁酸显酸性.
(2)小芳同学根据蚁酸中含有______元素,推测出蚁酸在隔绝空气并加热分解时生成水.
(3)对它分解生成的另一种氧化物,小敏提出两种猜想:猜想Ⅰ是CO2; 猜想Ⅱ是____________;
他们按如图所示进行实验:先向装置中通入一会N2,再将蚁酸分解产生的气体通入其中.
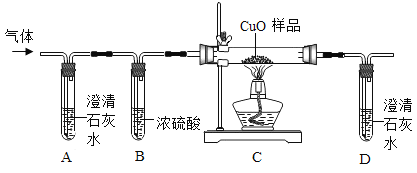
①先通N2的目的是_________________;
②若装置A中无明显变化,则猜想Ⅰ________(填“成立”或“不成立”);
③装置C发生反应的方程式为_______________________;
④装置D中的现象为_________________________;
[结论]甲酸受热能分解,反应的化学方程式是____________________;
[讨论交流]从环保角度看,该装置存在的明显缺陷是_________________.
[拓展延伸]小组同学利用蚁酸分解产生的气体,测定C装置中10g氧化铜样品(杂质不参与反应)中氧化铜的质量分数,在不同时刻测定C中固体的质量(如表):
反应时间/min | 2 | 4 | 6 | 8 | 10 |
固体质量/g | 9.3 | 8.8 | 8.5 | 8.4 | 8.4 |
分析表中数据,完成以下问题:
①在称量质量过程中,必须把玻璃管两端封住,目的是_________________;
②样品中氧化铜的质量分数是________________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是金元素在元素周期表中的信息示意图.从中可获取的信息是( )

A. 金元素属于非金属元素
B. 一个金原子的中子数为197
C. 一个金原子的核外电子数为79
D. 一个金原子中所含粒子总数为197
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知氧化铜样品中主要成分是CuO,还含有少量杂质。为了测定样品中氧化铜的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
(资料1)草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4·3H2O ![]() CO2↑+ CO↑+ 4H2O
CO2↑+ CO↑+ 4H2O
(资料2)浓硫酸具有吸水性,是常见的液态干燥剂。碱石灰是生石灰和氢氧化钠的固体混合物,是常见的干燥剂,能吸收水和二氧化碳。
(1)下列可用作草酸分解制取气体的装置是__________(填字母编号)。

(问题讨论)用下图所示装置进行实验:

(2)实验前应先_____________。
(3)进入C中的气体是纯净、干燥的CO,则A、B中的试剂依次是___________(填字母编号)。
a 浓硫酸 b 足量的澄清的石灰水
(4)A装置的作用是__________,写出相应的方程式_____________。
(5)对C装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前_______________。 ②停止加热后________________。
(数据分析与计算)
称取氧化铜样品10.0g,用上述装置进行实验,完全反应后,称得C装置中剩余固体的质量为8.4g,求原样品中氧化铜的质量分数______________?(写出计算过程)
(实验评价)
反思1:请指出(问题讨论)中实验装置的一个明显缺陷__________。
反思2: 本实验中如果缺少B装置(不考虑其它因素),则测得样品中氧化铜的质量分数与实际值相比会__________(填“偏小”、“不变”或“偏大”)。
反思3:不用上述方法,通过测定________ 装置(填序号)的质量变化,也可以获得氧化铜质量的分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我州石灰石资源丰富,某课外小组同学为了测定石灰石中碳酸钙的质量分数,取某地石灰石样品9.0g于烧杯中,将50g稀盐酸分5次加入烧杯中,充分反应后(杂质不与稀盐酸反应),测得剩余固体的质量记录如下。
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸质量/g | 10 | 10 | 10 | 10 | 10 |
剩余固体质量/g | 7.0 | 5.0 | 3.0 | 1.5 | X |
请计算:
(1)X的值为 。
(2)该石灰石样品中碳酸钙的质量分数为 。
(3)所用稀盐酸溶质的质量分数。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学反应的微观示意图如下,根据该图得出的结论,正确的是( )
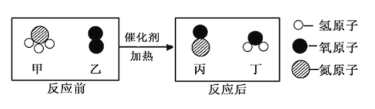
A. 四种物质中只有丁属于氧化物 B. 生成的丙和丁的分子个数比为 1:1
C. 丙物质中氮、氧元素的质量比为 7:8 D. 反应前后只有氢元素的化合价发生了变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取10g石灰石样品于烧杯中,再向其中加入足量稀盐酸(杂质不反应),有关实验数据见下表:
反应前 | 反应后 | |
烧杯与稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
160g | 10g | 166.7g |
(1)CaCO3中Ca元素的质量分数为____________。
(2)生成CO2的质量____________。
(3)求石灰石样品中碳酸钙的质量分数____________(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从微观的角度了解物质极其变化,有助于更好的认识物质组成和变化的本质。
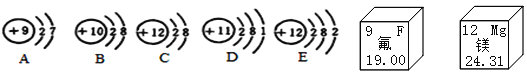
(1)已知A的相对原子质量为19,粒子A核内中子数为___________,A与E形成化合物的化学式为_____________。
(2)粒子A、B、C、D、E中,属于同一种元素的是___________(填序号),属于第二周期的元素共___种。
(3)D、E化学性质不同的原因是_____________。
(4)如图为两种化合物在一定条件下发生反应的微观示意图:

①该反应的化学方程式为__________________。
②上述反应中,作为还原剂的物质是________________(填物质化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组同学分别完成了图1所示的3个实验(图中a处连接压强传感器)。图2中的曲线1、2、3分别表示加入等体积相应液体后,烧瓶1、2、3内压强随时间的变化趋势。

下列说法不正确的是
A. 由于注入液体压缩了瓶内的气体,所以三个实验的起始阶段压强都快速增大
B. 对比曲线1和2可知,二氧化碳和水一定发生了化学反应
C. 对比曲线1和3可知,二氧化碳和氢氧化钠一定发生了化学反应
D. 对比曲线2和3可知,40% NaOH溶液比饱和石灰水更适合吸收二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com