
(7分)工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液(含NaOH35%~48%)。某学习小组为了验证附近氯碱化工厂产生的NaOH溶液是否达到高浓度标准,进行了如下操作,请你参与计算:
(1)到工厂采集了电解槽中的NaOH溶液100g。NaOH中氧元素的质量分数 是 。
(2)在实验室用如图所示浓硫酸配制200g24.5%的稀硫酸,计算所取浓硫酸的体积(计算结果取整数)。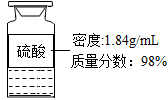
(3)进行中和测定,向采集到的溶液中逐滴加入所配制的稀硫酸,并不断测定溶液的pH值,当pH=7时,消耗稀硫酸160g。通过计算判断此时电解槽中NaOH溶液是否达到高浓度标准。
(1)40%(2)需要浓硫酸的体积为200g×24.5%÷98%÷1.84g/ml≈27ml
(3设参加反应的氢氧化钠的质量分数为X
H2SO4 + 2NaOH==Na2SO4+2H2O
98 80
160g×24.5% 100gX
98:80=160g×24.5%:100gX
X=32%
32%<35% 所以该溶液没有达到高浓度标准
解析试题分析:(1)根据氢氧化钠的化学式,可计算其中所含氧元素的质量分数为: ×100%=40%
×100%=40%
(2)稀释浓硫酸时,其中的溶质的质量不变。具体解题过程为:
需要浓硫酸的体积为200g×24.5%÷98%÷1.84g/ml≈27ml
(3)根据题意可知:反应为硫酸与氢氧化钠反应生成硫酸钠和水。已知量为硫酸的质量,未知量为氢氧化钠溶液的溶质质量分数。解题思路:可根据化学方程式中氢氧化钠与硫酸的质量关系,先求出反应的氢氧化钠的质量。然后再根据溶质质量分数计算的方法,求出氢氧化钠溶液的溶质质量分数,即可判断具体解题过程如下:
解:(1)氢氧化钠中所含氧元素的质量分数为: ×100%=40%
×100%=40%
(2)需要浓硫酸的体积为200g×24.5%÷98%÷1.84g/ml≈27ml
(3设参加反应的氢氧化钠的质量分数为X
H2SO4 + 2NaOH==Na2SO4+2H2O
98 80
160g×24.5% 100gX
98:80=160g×24.5%:100gX
X=32%
32%<35% 所以该溶液没有达到高浓度标准
答:(1)氢氧化钠中氧元素的质量分数为40%。
(2)需要浓硫酸的体积为27ml
(3)电解槽中NaOH溶液没有达到高浓度标准。
考点:根据化学方程式的计算


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:初中化学 来源: 题型:单选题
将17.4g部分变质的氢氧化钙,加入到200g7.3%的稀盐酸中,恰好完全反应,则所得溶液中溶质的质量为
| A.11.1g | B.14.2g | C.22.2g | D.44.4g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
化学在防治大气污染和水污染等方面发挥了重要作用,使更多地化学生产工艺和产品向着环境友好的方向发展.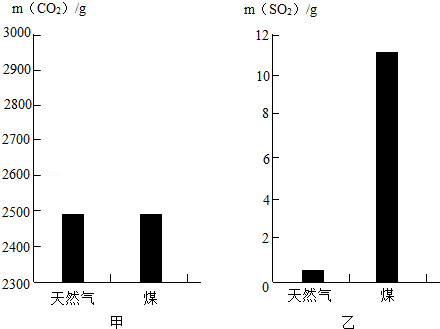
(1)为从源头消除污染,生产、生活中要选择对环境影响小的燃料,已知充分燃烧1kg天然气和煤所产生的CO2和SO2气体的质量如图所示,则 燃烧产生的气体更易导致酸雨.
(2)某火力发电厂为了防止环境污染,需将废气中的二氧化硫进行处理,其发生的主要反应为2CaCO3+2SO2+O2=2CaSO4+2CO2,若100g废气中含有1.6g二氧化硫,则处理1000g这种废气需含碳酸钙80%的石灰石 g.
(3)某工厂以流量10L/s(升/秒)排出含硫酸9.8%的工业废水,现向该废水中排入含氢氧化钠2%的工业废水,与硫酸反应后再排出,要使处理后的废水呈中性,则含氢氧化钠2%的工业废水的流量应为 L/s(上述含酸废水和含碱废水的密度均近似为1g/cm3).
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.
(1)反应中生成 g二氧化碳,此反应的基本反应类型为 ;
(2)通过计算说明实际钙含量是否与标注相符;
(3)试计算所用稀盐酸的溶质质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室制取二氧化碳后,将废液过滤,得到含有氯化钙和稀盐酸的混合液,20℃时,取混合液141.2g于烧杯中,向其中逐滴滴加溶质质量分数为10.6%的碳酸钠溶液,所产生的沉淀与所滴入碳酸钠溶液的质量关系如图所示。当滴入碳酸钠溶液至图中A点时,通过计算确定所得溶液是否为饱和溶液。(提示:20℃时,氯化钠溶解度为36克。)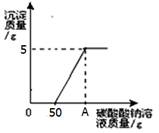
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)工业上通常用黄铁矿(主要成分FeS2)为原料生产硫酸,先将黄铁矿粉碎,然后按照以下流程制备硫酸: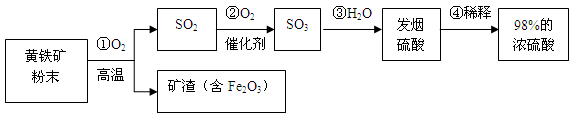
⑴ 先将黄铁矿石粉碎的目的是 。
⑵ 写出稀释浓硫酸的具体操作步骤 。
⑶ 将10g98%的浓硫酸稀释成9.8%的稀硫酸,需要加水 g。
⑷ 取20g矿渣样品(含Fe2O3),向其中加入300g溶质质量分数为9.8%的稀硫酸(已知矿渣中的Fe2O3与稀硫酸恰好完全反应得到Fe2(SO4)3溶液),试通过化学方程式计算该矿渣样品中Fe2O3的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
小明在实验室里加热31.6g高锰酸钾制取氧气,完全反应后剩余固体质量为28.4g。将剩余固体溶解、过滤、烘干上,回收二氧化锰。请计算:
(1)生成氧气的质量为 g。
(2)回收二氧化锰的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(12分)下图是某同学完成《实验活动5 一定质量分数的氯化钠溶液的配制》中“配制
50 g质量分数为6%的氯化钠溶液”的全过程。
(1)图中的错误有:
① ;
② 。
(2)若所配制的盐水中NaCl 的质量分数小于6%,则可能造成误差的原因有(至少举
出两点)。
① ;
② 。
(3)由浓溶液配制稀溶液时,计算的依据是 。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是 。在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、冷却至室温装瓶并贴上标签。
(4)取某稀硫酸样品10g,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌。溶液pH的变化如图所示。试回答: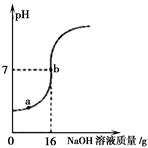
①a点溶液中含有的离子有 。
②当pH=7时,消耗NaOH溶液中NaOH的质量为 g。
③计算稀硫酸的溶质质量分数。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
化学兴趣小组在化学实验室发现了一瓶已部分变质的氢氧化钠溶液,想测试它的变质情况。小组同学取10g该溶液放入烧杯中,然后将20g稀盐酸分4次加入同一个烧杯中充分反应,反应后称量质量。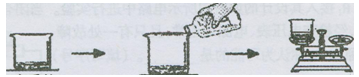
变质的 分四次 每次反应后
NaOH溶液 加入稀盐酸 称量质量
实验过程的数据记录如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 稀盐酸的质量(g) | 5 | 5 | 5 | 5 |
| 反应后烧杯内物质的质量 | 15 | 19.56 | 24.12 | 29.12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com