
| 矿石名称 | 辉铜矿 | 孔雀石 | 黄铜矿 |
| 主要成分 | Cu2S | CuCO3•Cu(OH)2 | CuFeS2 |
| 溶解性 (20℃) | 离子 | OH- | Cl- | CO32- |
| Cu2+ | 不 | 溶 | 不 | |
| 有关反应 | CuCO3•Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O | |||
| CuCO3+2HCl═CuCl2+H2O+CO2↑ | ||||
分析 (1)根据硫化亚铜的化学式进行计算;
(2)根据铜绿的组成和性质判断清除方法,铜绿中含有碳酸根和氢氧根,可以与稀盐酸反应;
(3)根据铜绿分解的化学方程式进行计算;
(4)氨水和硫酸反应生成硫酸铵.
解答 解:(1)硫化亚铜中,铜的质量分数应=$\frac{64×2}{64×2+32}$×100%=80%,但在辉铜矿中除了硫化亚铜还含有其他一些不含铜元素的杂质,故辉铜矿中铜的质量分数小于80%;
(2)因为铜绿不溶于水,故不能用水清洗,铜绿能和盐酸反应生成可溶性铜盐,故可用盐酸清洗,铜绿加热时生成氧化铜,故也不能完全除去,因此选择方案Ⅱ;
(3)设加热2.22g CuCO3•Cu(OH)2,使之完全分解,生成氧化铜的质量为x
CuCO3•Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑
222 160
2.22g x
$\frac{222}{2.22g}$=$\frac{160}{x}$
x=1.6g
答:剩余固体的质量为1.6g
(4)氨水和硫酸反应生成硫酸铵.
故答案为:(1)<;
(2)Ⅱ;
(3)1.6g.
(4)(NH4)2SO4,
点评 解答本题的关键是要掌握化学方程式的书写方法、根据化学方程式的计算及其各种物质的性质方面的知识,只有这样才能对问题做出正确的判断.


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:初中化学 来源: 题型:选择题
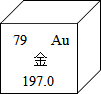 如图是金元素在元素周期表中的信息示意图.从图中获取的信息正确的是( )
如图是金元素在元素周期表中的信息示意图.从图中获取的信息正确的是( )| A. | 金元素属于非金属元素 | B. | 一个金原子的中子数为197 | ||
| C. | 一个金原子质子数为79 | D. | 一个金原子的核外电子数为118 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 不饱和溶液转化为饱和溶液,其溶质的质量分数一定增大 | |
| B. | 饱和溶液析出晶体后,溶质的质量分数一定减小 | |
| C. | 只要温度不变,某饱和溶液中固体溶质的溶解度一定不变 | |
| D. | 降温时,饱和溶液一定会析出晶体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 0个 | B. | 1 个 | C. | 2 个 | D. | 4个 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A.生活中的物质 | B.安全常识 | C.元素与人体健康 | D.日常生活经验 |
| 铅笔芯主要成分--石墨 饮水机滤芯的吸附剂主要成分--活性炭 | 进入陌生溶洞前--先做灯火实验 闻试剂气味--鼻子尽量靠近试剂瓶口 | 缺铁--易引起贫血 缺碘--易患甲状腺肿大 | 区别老陈醋与酱油--闻气味 区分羊毛纤维与合成纤维-灼烧后闻气味 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 现象 | 结论和解释 | |
| ①取上述反应后的溶液,加入足量的CaCl2溶液 | 有白色沉淀生成 | 原溶液中有Na2CO3(填写化学式,下同) 反应的化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl |
| ②将①所得的浑浊液过滤,向滤液中加入足量的稀盐酸 | 产生大量气泡 | 原溶液中有Na2CO3 |
| ③另取②中的滤液,滴入几滴酚酞溶液, | 溶液由无色变成浅红色 | 滤液显碱性 |

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤及现象 | 实验结论(填离子符号) |
| 取废水样品观察,呈无色 | 废水中不含Fe3+、Cu2+ |
| 测所取废水样品的pH,pH=13 | 废水中含较多的OH- |
| 向废水样品中加入过量的稀盐酸,没有气泡产生 | 废水中不含CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com