
(6.5分)我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石。用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为: 3CO+ Fe2O3
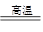 2Fe + 3CO2 。
2Fe + 3CO2 。
(1)上述反应不是置换反应的理由是: 。
(2)Fe2O3中铁元素的质量分数:
(3)根据化学方程式计算:用含Fe2O385%的赤铁矿石800 t,理论上可炼出含杂质3%的生铁多少吨?
科目:初中化学 来源: 题型:
(6.5分)我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石。用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为: 3CO+ Fe2O3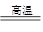 2Fe + 3CO2 。
2Fe + 3CO2 。
(1)上述反应不是置换反应的理由是: 。
(2)Fe2O3中铁元素的质量分数:
(3)根据化学方程式计算:用含Fe2O385%的赤铁矿石800 t,理论上可炼出含杂质3%的生铁多少吨?
查看答案和解析>>
科目:初中化学 来源: 题型:
 2Fe + 3CO2 。
2Fe + 3CO2 。查看答案和解析>>
科目:初中化学 来源:2011—2012学年度重庆市凤鸣山中学九年级下学期第八单元测试化学试卷 题型:填空题
(6.5分)我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石。用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为: 3CO+ Fe2O3 2Fe + 3CO2 。
2Fe + 3CO2 。
(1)上述反应不是置换反应的理由是: 。
(2)Fe2O3中铁元素的质量分数:
(3)根据化学方程式计算:用含Fe2O385%的赤铁矿石800 t,理论上可炼出含杂质3%的生铁多少吨?
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
(1)(1分)我们把直接从自然取得的能源称为一次能源,一次能源经过加工取得的能源称为二次能源。下列是目前正在利用和开发的部分能源 ①煤;②汽油;③天然气;④太阳能;⑤风能;⑥潮汐能;⑦地热能;⑧电能;⑨氢能;⑩酒精,其中不属于一次能源的是(填序号) 。
(2)(2分)我国是世界产煤大国。但含硫煤燃烧排放的SO2会引起“酸雨”现象。为减少大气污染,某发电厂采用了“石灰固硫法”,即向煤中掺入生石灰CaO,用来吸收SO2,写出“固硫法”反应的化学方程式 。
(3)(2分)科学家预言,氢能将成为21世纪的主要绿色能源,而水是自然界中广泛存在的物质,你认为获取氢气的最佳途径是 ,目前要实现这个途径最关键的问题是要研制出 。
(4)(2分)目前我国许多城市已使用乙醇汽油。我市是著名的商品粮基地,但每年都有大量的过期粮食——陈化粮出现,人们用陈化粮来生产酒精,其过程为:
陈化粮 葡萄糖 酒精+二氧化碳
试写出由葡萄糖制取的化学方程式 。
(5)(2分)电池是一种将 能转化为电能的装置。锂电池是一种新型的高能电池,其质量轻,电容量大,颇受手机、手提电脑等制造商的青睐。某种锂电池的总反应式为Li+MnO2=LiMnO2,其中化合价发生变化的元素是 。
15、某研究学习小组经过查阅资料发现,锰(Mn)也能排入下列金属活动性顺序中(说明:除出现了Mn外,其他金属的活动性强弱顺序的排列与课本中的一致):
K、Ca、Na、Mg、Al、Mn、Zn、 ①、 ② 、 ③ 、(H)、④、 ⑤ 、 ⑥ 、Pt、Au
(1)上述金属活动性顺序中①的元素符号是牋牋牋牋牋牋牋牋牋;
(2)已知锰盐中锰元素显+2价。写出金属锰和金属⑥的硝酸盐溶液发生的置换反应的化学方程式牋牋牋牋牋牋牋牋牋牋牋 。
(3)请设计实验比较Mn和金属④金属活动性的强弱:
实验操作 | 实验现象 | 结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com