
【题目】【2016年湖南省湘潭市】往硫酸和硫酸铜的混合溶液中,逐滴加入氢氧化钠溶液直至过量,根据实验实施绘制如图所示曲线,下列说法正确的是( )
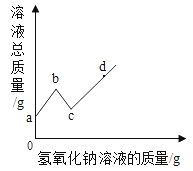
A.a至b段有蓝色沉淀生成 B.d点溶质种类为三种
C.c至d段,溶液pH不断减少 D.c点所含的溶质种类最少
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:初中化学 来源: 题型:
【题目】【2016年甘肃省张掖市】甲、乙、丙三种物质的溶解度曲线如图所示。据图回答:
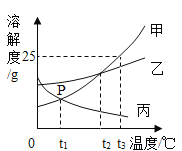
(1)p点的含义是___________.
(2)t3℃时,将25g甲物质放入50g水中,充分溶解后,该溶液中溶质的质量分数为_________。
(3)甲物质中含有少量的乙物质,要提纯甲物质,通常采用的方法是__________。
(4)将t2℃时的甲乙丙三种物质的饱和溶液降温至t1℃时,所得溶液中溶质的质量分数由大到小的顺序是 __________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“恒大冰泉”是来自长白山的天然矿泉水,判断“恒大冰泉”属于溶液的依据是( )
①无色 ②混合物 ③化合物 ④均一性 ⑤稳定性.
A. ①②④ B. ②④⑤ C. ①③⑤ D. ③④⑤
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列对分子、原子、离子的认识,正确的是
A.原子是一切变化中最小粒子,不可再分
B.在化学变化中分子不改变
C.温度越高,分子运动越快
D.钠原子和钠离子的化学性质相同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【2016年广西省玉林市、防城港市】图1是某兴趣小组在学习碱的性质时进行的探究活动,请要求回答问题。
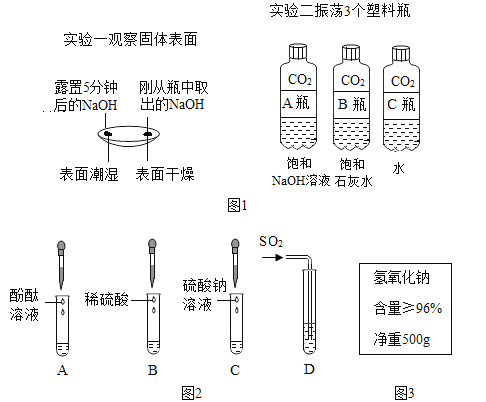
(1)通过分析实验一可知,氢氧化钠会吸收空气中的________.
(2)实验二中观察到3个塑料瓶变瘪的程度为A>B>C,可证明CO2能与NaOH、Ca(OH)2反应,其中C瓶在实验中起 _________作用。
(3)晓晓查阅资料了解到往Ba(OH)2溶液中滴加或通入下列图2中物质会产生如下现象:A中溶液显红色,B、C、D中均产生白色沉淀.
①写出D试管中反应的化学方程式 _________.
②不同的碱溶液中都含有OH﹣,所以,碱有一些相似的化学性质.上述关于Ba(OH)2性质的实验不能体现碱的相似性质的是 _________(填字母序号)
(4)冬冬发现工业上使用的氢氧化钠固体标签如图3所示,于是对其所含杂质进行了探究.
【提出问题】 _________
【提出猜想】
猜想I:查阅资料可知,工业用氢氧化钠可能含有NaCl.
猜想Ⅱ:工业用氢氧化钠可能含有Na2CO3,原因是 _________(用简洁的文字表述).
【进行实验】
实验步骤 | 实验现象 | 解释或结论 |
①取适量固体样品于试管中,加水溶解 | 固体全部溶解 | / |
②向①所得溶液中滴加过量的 _________ | 一开始无明显变化,一会儿后产生能使澄清石灰水变浑浊的气体 | 样品中含有Na2C03 |
③向②所得溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有NaCl.反应的化学方程式为 _________ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关空气的成分说法错误的是
A.空气中含量最多是氮气
B.空气中的稀有气体常用作保护气
C.二氧化碳含量非常少,但却是植物进行光合作用必需的物质
D.氧气约占空气体积的1/5,且易溶于水,可以供给水中生物呼吸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【2016年黑龙江省绥化市】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
【査阅资料】
①NaN3受撞击会生成Na、N2 ②NaN3遇盐酸、H2SO4溶液无气体生成
③碱石灰是CaO和NaOH的混合物 ④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和NH3
【问题探究】
(1)汽车受撞击后,30毫秒内引发NaN3迅速分解,该反应的化学方程式为___________;
(2)工业级NaN3中常含有少量的Na2CO3,其原因是___________(用化学方程式表示);
(3)为测定某工业级NaN3样品中Na2CO3的质量分数,小组同学设计了如图实验装罝:
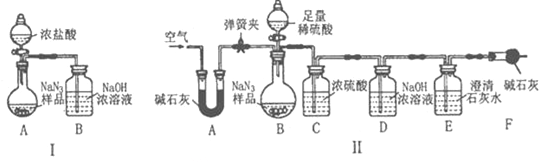
①小明同学认为通过测定装置I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的质量分数,小组同学通过讨论认为不可行,其理由可能是___________(答出一种即可)
②小明同学在大家讨论的基础上,又设计了装罝Ⅱ,请分析:装置Ⅱ中A的作用是___________.若无装置C,对测定结果造成的影响是 (填“偏大”、“偏小”或“无影响”).装置E的作用是___________.
③根据装置Ⅱ,小组同学设计的实验步骤有:
a.称量装置D
b.称量样品,检査装置气密性
c.打开弹簧夹,鼓入空气
d.关闭弹簧夹,打开分液漏斗的活塞和玻璃塞,注入足量的稀琉酸,关闭活塞和玻璃塞.
其正确的顺序为___________(填字母序号,可重复)
④计算碳酸钠的质量分数时,至少需要测定___________个数据.(填数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com