
(6分)下表是元素周期表的一部分:
|
族 周期 |
IA |
|
0 |
|||||
|
一 |
1 H 1.008 |
ⅡA |
ⅢA |
ⅣA |
V A |
ⅥA |
ⅦA |
2 He 4.003 |
|
二 |
3 Li 6.941 |
4 Be 9.012 |
5 B 10.81 |
6 C 12.01 |
7 N 14.01 |
8 O 16.00 |
9 F 19.00 |
10 Ne 20.18 |
|
三 |
11 Na 22.99 |
12 Mg 24.31 |
13 Al 26.98 |
14 Si 28.09 |
15 P 30.97 |
16 S 32.06 |
17 Cl 35.45 |
18 Ar 39.95 |
(1)Ne元素的原子核电荷数为_______,形成单质的化学式是 。
(2)某元素的原子结构示意图如右,则X的值为 。该元素与17号元素形成的化合物的化学式是 ,化合物中阴离子的结构示意图是 。

(3)请用表中的元素符号所组成的反应物写出符合要求的化学方程式:有水生成的化合反应:________________________________________。
科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 一 | 1H 1,008 |
ⅡA | ⅢA | ⅣA | V A | ⅥA | ⅦA | 2He 4,003 |
| 二 | 3Li 6,941 |
4Be 9,012 |
5B 10,81 |
6C 12,01 |
7N 14,01 |
8O 16,00 |
9F 19,00 |
10Ne 20,18 |
| 三 | 11Na 22,99 |
12Mg 24,31 |
13Al 26,98 |
14Si 28,09 |
15P 30,97 |
16S 32,06 |
17Cl 35,45 |
18Ar 39,95 |
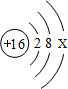
查看答案和解析>>
科目:初中化学 来源: 题型:
| 1H | 2He | ||||||
| 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne |
| 11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar |
 ,则m=
,则m=
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| 1H 氢 |
2He 氦 | |||||||
| 3Li 锂 |
4Be 铍 |
… | 5B 硼 |
6C 碳 |
7N 氮 |
8O 氧 |
9F 氟 |
10Ne 氖 |
| llNa 钠 |
12Mg 镁 |
… | 13A1 铝 |
14Si 硅 |
15P 磷 |
16S 硫 |
17C1 氯 |
18Ar 氩 |
| 19K 钾 |
20Ca 钙 |
… | ||||||
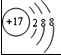 表示的是
表示的是 ”表示氢原子,用“
”表示氢原子,用“ ”表示氮原子,用“
”表示氮原子,用“ ”表示氯原子,上述反应过程可用图1表示:
”表示氯原子,上述反应过程可用图1表示: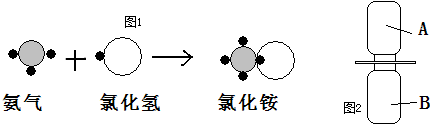
查看答案和解析>>
科目:初中化学 来源: 题型:
| 周期 族 | IA | 0 | |||||||
| 1 | 1 H 氢 1.008 |
2 He 氦 4.003 |
|||||||
| IIA | IIIA | IVA | VA | VIA | VIIA | ||||
| 2 | 3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
|
| 3 | 11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com