
【题目】如图是截取容器部分的物质变化过程微观示意图:
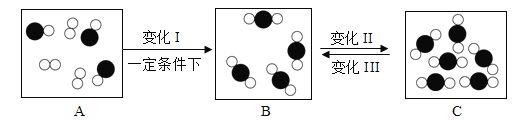
(1)变化过程中参加反应的“ ![]() ”和“
”和“ ![]() ”的分子个数比为_________ 。
”的分子个数比为_________ 。
(2)若“![]() ”表示氧原子,画出氧原子结构示意图___________。
”表示氧原子,画出氧原子结构示意图___________。
(3)变化Ⅱ属于___________变化。(填“物理”或“化学”)
科目:初中化学 来源: 题型:
【题目】阅读下列科普短文并回答问题:

纯碱的用途非常广泛。纯碱工业始创于18 世纪,西方国家对这一技术采取了严格的保密措施。一些专家想探索此项技术的秘密,均以失败告终。1943年,我国化学工程专家侯德榜针对西方纯碱生产时食盐利用率低,制碱成本高,废液、废渣污染环境和难以处理等不足,发明了侯氏制碱法又称联合制碱法。
发明原理
第一步:氨气与水和二氧化碳反应生成一分子的碳酸氢铵。先添加NH3而不是CO2:CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性(用无色酚酞溶液检验),能够吸收大量CO2气体。
第二步:碳酸氢铵与氯化钠反应生成氯化铵和碳酸氢钠沉淀。
第三步:在5℃~ 10℃时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥。向时液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度。联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。NH3、CO2 都来自于合成氨工艺:这样NH4Cl就成为另一产品化肥。综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
第四步:加热碳酸氢钠制取纯碱。
温度溶解度物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
NH4HCO3 | 11.9 | 16.1 | 21.7 | 28.4 | 36.6 | 44.1 | 59.2 |
NaHCO3 | 6.9 | 8.15 | 9.6 | 11.1 | 12.7 | 14.4 | 16.4 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |

阅读短文,回答下列问题:
(1)写出侯氏制碱法第二步的化学反应方程式_____。
(2)饱和食盐水中持续通入氨气和二氧化碳气体后,溶液中大量存在的离子有_____。
(3)第二步的复分解反应发生时,常温下向溶液中持续通入氨气和二氧化碳气体,碳酸氢钠以沉淀的形式先析出的原因是_____。
(4)写出侯氏制碱法的一个优点_____。
(5)循环利用的物质是_____。
(6)侯氏制碱法中没有涉及的化学反应类型是_____。
(7)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制取某些气体的装置图如下。请按要求回答问题。
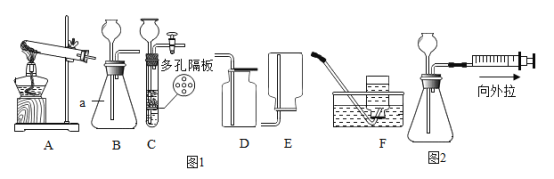
(1)写出标有序号的仪器名称:①______________;②________________。
(2)实验室用氯酸钾制取氧气的化学方程式为________________。如果忘记了加二氧化锰, 其后果是________________。
(3)实验室制取CO2时,若用C装置代替B装置作为发生装置,优点是__________;收集CO2时,为了检查气体是否收集满,采用的方法是__________。
(4)实验室制取O2和H2时,无论选择什么药品,都能选用的装置是______(填字母)。
(5)如图2所示,利用注射器可以检查装置B的气密性;先在瓶内装适量的水,使长颈漏斗下端管口液封,将活塞缓慢往外拉,若观察到_________,则装置不漏气。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用甲和乙反应制备燃料丙。根据下列微观示意图得出的结论中,正确的是
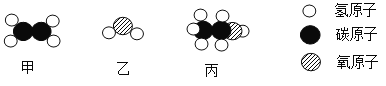
A.甲的化学式为CH2
B.反应中甲、乙、丙的分子个数比为2:1:1
C.甲、乙、丙都是氧化物
D.丙中C、H、O元素的质量比为12:3:8
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】C、CO2和CO都是我们熟悉的物质,关于C、CO2和CO有以下几种说法:
①二氧化碳和一氧化碳元素组成相同,性质完全相同
②固体二氧化碳升华吸收大量的热,所以干冰可用于人工降雨
③金刚石和石墨碳原子排列方式不同,所以他们的化学性质差异很大
④二氧化碳不能供给呼吸,是因为二氧化碳有毒
⑤一氧化碳具有还原性,所以一氧化碳可以用来炼铁
⑥一氧化碳能与人体内的血红蛋白结合,使人缺氧中毒而亡
⑦二氧化碳通入紫色石蕊试液,溶液变红,说明二氧化碳是酸
⑧通过化学反应,三者可以按照C→CO2![]() CO的方向转化
CO的方向转化
以上几种说法正确的是![]() ( )
( )
A.①②③⑥B.②⑤⑥⑧C.②④⑥⑦D.③④⑤⑦
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。小刚叫来小军和小红,共同探究这种白色粉末的成分。
(提出问题)白色粉末的成分是什么?
(进行猜想)他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH;②可能是Na2CO3;③可能是NaOH与Na2CO3的混合物。
(设计实验)
(1)为了验证猜想,小军做了下面的实验:
序号 | 实验操作 | 实验现象 | 结论 |
1 | 取少量白色粉末,滴加足量稀盐酸 | 气体生成 | 猜想______不正确 |
2 | 取少量白色粉末溶于水,向所得溶液中滴加无色酚酞溶液 | ________________ | 猜想③正确 |
(反思改进)
(2)小红认为小军实验2不能得出猜想③正确,请说明理由__________________
(3)小刚认为小红说的对,为了验证猜想③,设计以下实验:
序号 | 实验操作 | 实验现象 | 结论 |
Ⅰ | 取少量白色粉末溶于水,向所得溶液中滴加过量 _________溶液 | 产生白色沉淀 | 猜想③正确 |
Ⅱ | 取实验Ⅰ的上清液,向溶液中滴加FeCl3溶液 | _______________ |
请你写出实验Ⅰ中反应的化学方程式____________。
(反思应用)氢氧化钠易潮解,且容易与空气中CO2发生反应,所以氢氧化钠固体应该_________保存。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碱式碳酸铜(Cux(OH)y(CO3)z)是一种用途广泛的化工原料,实验室制取碱式碳酸铜的步骤如下。
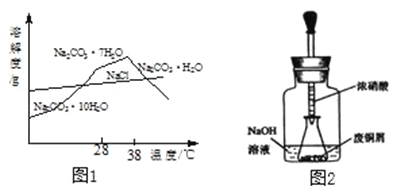
已知:①Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+4H2O;②2NO2+2NaOH=NaNO3+NaNO2+H2O
步骤一:制Na2CO3
从Na2CO3溶液(含少量NaCl)提纯获得Na2CO3固体的步骤如下:蒸发浓缩,38℃以上结晶,趁热过滤,洗涤,加热脱水,得Na2CO3固体。结合如图1回答。
(1)38℃以上结晶的目的是_____。
(2)洗涤时,适宜的试剂是_____。
a热水 b冰水 c盐酸 dCa(OH)2溶液
步骤二:制Cu(NO3)2
如图2,用滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到Cu(NO3)2溶液。
步骤三:碱式碳酸铜的制备
向大试管中加入Na2CO3溶液和Cu(NO3)2溶液,水浴加热至70℃左右,用NaOH稀溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
(3)如图装置中NaOH溶液的作用是_____。反应结束后,广口瓶内溶液中的溶质有NaOH、_____、_____(填写化学式)。
(4)步骤三中,水浴加热所需仪器有_____、_____ (加热、夹持仪器、石棉网除外);洗涤的目的是_____。
(5)影响产品产量的主要因素有_____和_____。
(6)加热碱式碳酸铜(Cux(OH)y(CO3)z)得40 g CuO和3.6 g H2O.则x:y:z=_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验小组用传感器探究氢氧化钠溶液和稀盐酸反应过程中温度和pH的变化,测定结果如图所示。
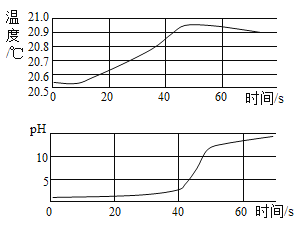
(1)根据图像判断,该实验是将_____(填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)30s时,溶液中溶质的化学式为_____。
(3)从能量的角度看,该反应属于_____(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧气是我们学过的一种重要物质,它在生产、生活中有利有弊。
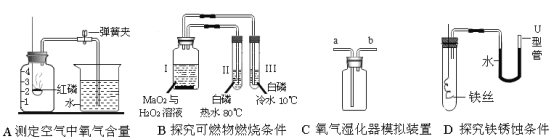
(1)保证实验A成功的条件有_____(填序号)。
A 装置气密性良好 B 红磷燃烧后,立即打开弹簧夹 C 红磷足量
(2)实验B仪器1中的化学反应方程式为_____。
(3)医院里给病人输氧时,为了给氧气加湿和观察氧气的输出速率,常在氧气瓶和病人吸氧管之间接入C图所示装置,在集气瓶装半瓶水,将_____(填“a”或“b”)端接氧气钢瓶。
(4)上述A、B、D三个实验中,能达到实验目的的是_____(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com