
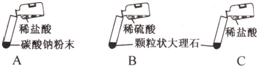
 某实验小组的同学用碳酸钠粉末、颗粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究实验室制取CO2的反应原理.请你参与下列探究并回答问题.
某实验小组的同学用碳酸钠粉末、颗粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究实验室制取CO2的反应原理.请你参与下列探究并回答问题.| 实验 | 实验现象 | 得出的结论 |
| A | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集,不宜于实验室制取CO2 |
| B | 产生气泡,速率迅速减慢,反应几乎停止 | 无法持续产生CO2,不能用于实验室制取CO2 |
| C | 产生大量气泡,反应连续且持续时间较长 产生大量气泡,反应连续且持续时间较长 |
反应速率适中,气体便于收集 反应速率适中,气体便于收集 |


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:初中化学 来源: 题型:
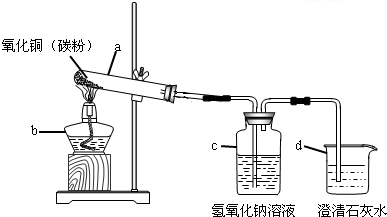
| 装置 | 反应前 | 反应后 |
| a | 试管的质量36.2g 氧化铜和炭粉混合物的质量为20.0g |
试管和固体物质的质量为54.8g |
| c | 反应后瓶内液体比反应前增重1.1g | |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
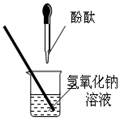 24、同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了.为此某化学小组的同学进行了如下探究.
24、同学们在探究碱溶液与酚酞溶液作用的实验时,发现了一个意外现象:向氢氧化钠溶液中滴入酚酞溶液(如图),溶液变成了红色,但是一会儿红色就消失了.为此某化学小组的同学进行了如下探究.| 实验步骤 | 实验目的 | 现象结论 |
| ①用煮沸过的蒸馏水配制某氢氧化钠溶液. | 排出水中溶解的氧气 | 溶液先变成红色,一会儿红色又消失. 丙同学的猜想不正确. |
| ②取少量上述氢氧化钠溶液,滴入酚酞,然后在上方滴一些植物油. | 隔绝空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:
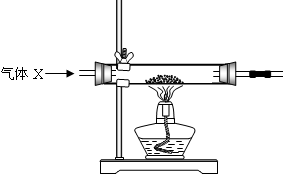
| 操作步骤 | 实验现象 | 结论 |
| 收集一试管该气体,将带火星的木条伸到试管口以内 | 乙同学的猜想不成立 | |
| 收集一试管该气体,将燃着的木条伸到试管口点燃 | 甲同学的猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
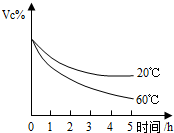 维生素C是一种人体必需的维生素,查阅资料可知下列信息:
维生素C是一种人体必需的维生素,查阅资料可知下列信息:| 部分性质 | 生理作用 | |
| 维生素C 化学式:C6H8O6 |
无色晶体,易溶于水,在酸性溶液中稳定,中性或碱性溶液中易被空气氧化… | 促进人体生长发育,增强人体对疾病的抵抗能力… |
查看答案和解析>>
科目:初中化学 来源: 题型:
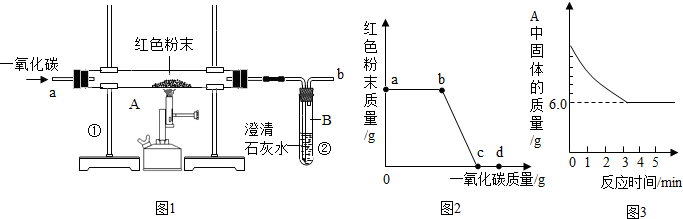
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com