
| A. | ①③④ | B. | ②④⑥ | C. | ①②⑤ | D. | ③④⑥ |
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:初中化学 来源: 题型:选择题
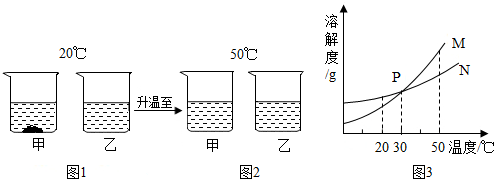
| A. | 30℃时a、b溶液质质量分数不相等 | B. | 图1中a溶液质质量分数比b溶液大 | ||
| C. | 图3中表示a的溶解度曲线是M | D. | 图2中a、b溶液一定都是饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气是由氧元素组成的,所以制取氧气的反应物中一定含有氧元素 | |
| B. | 感应电流是由导体切割磁感线产生的,所以导体切割磁感线就一定能产生感应电流 | |
| C. | 可燃物的燃烧时温度必须达到着火点,所以温度达到了着火点,可燃物就能燃烧 | |
| D. | 单质中只含有一种元素,所以只含一种元素的物质一定是单质 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解 度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| A. | 20℃时将20g KNO3加入到50g水中,能得到65.8g溶液 | |
| B. | KNO3的溶解度比NaCl的溶解度大 | |
| C. | 60℃时将210g KNO3饱和溶液降温至20℃,溶液质量变为131.6g | |
| D. | 20℃时将40g NaCl加入到100g水中,再升温至60℃可形成不饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
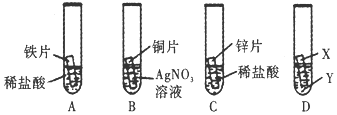
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com