
实验室制取气体时需要的一些装置如下图所示,请回答下列问题。
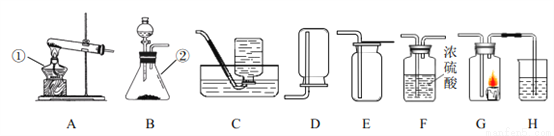
(1)写出标有序号的仪器名称:①______,②______。
(2)实验室制取氧气和二氧化碳的发生装置都可选用 B 装置的原因是______,装置中使用分液漏斗的优点是______。
(3)若要得到干燥的氧气,所选择装置的连接顺序为:B→______→______(填字母序号)。
(4)检验二氧化碳是否收集满的操作方法是______。
(5)某兴趣小组的同学连接 B、G、H 装置进行实验。若实验时 G 装置中蜡烛燃烧更剧烈,H 装置中溶液变浑浊,则 B 装置中反应的化学方程式为______。
酒精灯; 锥形瓶; 反应物是固体和液体,反应不需要加热; 可以控制反应速率,节约药品; F; E; 将一根燃着的木条平放在集气瓶口,木条熄灭,证明二氧化碳收集满(答案合理即可); 2H2O22H2O+O2↑ 【解析】(1)根据常见仪器解答;(2)根据反应物的状态、反应条件解答;根据可以控制反应速率,节约药品解答;(3)根据先干燥、后用向上排空气法收集解答;(4)根据将燃着的木条置于集气瓶口,... 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:初中化学 来源:新疆2018年中考化学试卷 题型:单选题
某种燃料是目前使用较多的“绿色可再生能源”,其在空气中完全燃烧的化学反应方程式:X+3O2 2CO2+3H2O。则X物质的化学式为( )
2CO2+3H2O。则X物质的化学式为( )
A. CH3COOH B. C2H5OH C. C2H4 D. C2H6
B 【解析】根据化学方程式X+3O22CO2+3H2O可知,生成物中碳原子、氧原子、氢原子的数目分别为2、7、6,反应物中碳原子、氧原子、氢原子的数目分别为0、6、0,根据质量守恒定律,X的化学式中应含有碳原子的数目为:2,应含有氧原子的数目为:2×2+3﹣3×2=1,应含有氢原子的数目为:2×3=6。可推断X的化学式为:C2H6O,即C2H5OH。故选B。查看答案和解析>>
科目:初中化学 来源:山东省济南市2018届九年级初中中考作业练习化学试卷 题型:科学探究题
铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
(提出问题)这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
(实验探究)同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中:
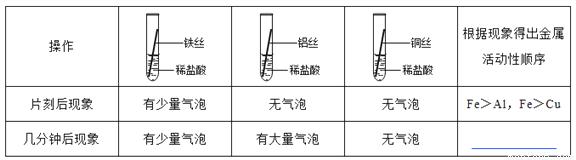
__________________
(讨论交流)为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
(反思评价)做金属性质实验时需将金属进行打磨,打磨的目的是____________, 铁与盐酸反应的方程式是___________________。
(实验验证)为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、 打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
操作 |
|
| 根据现象得出金属活动性顺序 |
现象 | 无明显现象 | ______________________ | Al>Fe>Cu |
写出铁与硫酸铜溶液反应的化学方程式__________________________。
(拓展迁移)若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为_______________________________。
Al>Fe>Cu 除去表面的氧化膜 Fe+2HCl=FeCl2+H2↑ 铁丝表面覆盖一层红色物质 Fe+CuSO4=FeSO4+Cu Cu Fe Al 或Fe Cu Al 【解析】【提出问题】铁丝表面产生少量气泡,铝丝表面产生大量气泡,铜丝表面不产生气泡,所以金属活动性顺序Al>Fe>Cu;【反思评价】实验中可以看出,铝丝表面开始不产生气泡,几分钟后产生大量的气泡,是因为表面有致密的氧化铝薄...查看答案和解析>>
科目:初中化学 来源:安徽省2018年中考化学 题型:单选题
对比实验是实验探究的重要方法,下列对比实验设计能实现相应实验目的的是
选项 | 实验目的 | 实验设计 | 选项 | 实验目的 | 实验设计 |
A | 探究温度对分子运动快慢的影响 |
| B | 探究水对铁钉锈蚀的影响 |
|
C | 探究空气是燃烧的必要条件 |
| D | 探究CO2与水反生反应 |
|
A. A B. B C. C D. D
A 【解析】A、红墨水分子在50mL的热水扩散的速度比冷水中快,故能说明分子运动速率随温度的升高而变快,正确; B、进行对比实验研究影响反应的因素时,要控制变量保持一致,探究水对铁钉锈蚀影响时,应控制铁钉都与氧气接触,其中一个不能与水接触,一个与水接触,错误; C、该实验中探究空气是燃烧的必要条件,应控制其他变量保持相同,应将红磷换成白磷进行对比实验,错误; D、酚酞在酸性...查看答案和解析>>
科目:初中化学 来源:山东省青岛市2018年中考化学试卷 题型:计算题
侯氏制碱法生产的碳酸钠中常含有少量的氯化钠。现有碳酸钠和氯化钠的混合物样品 12.5 g,将其放入干净的烧杯中,加入 100 g 水,使其完全溶解。向所得溶液中加入溶 质质量分数为 7.3%的稀盐酸,烧杯中溶液的质量与加入稀盐酸的质量关系曲线如图所示。请回答下列问题。
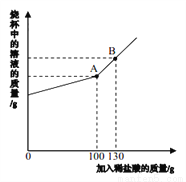
(1)B 点时,烧杯中溶液里存在的阳离子为_____(填写离子符号)。
(2)在碳酸钠和氯化钠的混合物样品中,含碳酸钠的质量为_____(结果精确至 0.1 g)。
(3)A 点时,求此温度下所得不饱和溶液中溶质质量分数_______(写出具体计算过程,计算结果精确至0.1%)。
Na+、H+; 10.6g; 6.5% 【解析】根据B点时盐酸过量分析解答;根据反应的化学方程式计算解答。(1)由图可知,当滴入稀盐酸至B点时,加入的稀盐酸过量。烧杯中溶液里的溶质为NaCl、HCl,故存在的阳离子为Na+、H+;(2)由图可知,当滴入稀盐酸至A点时,加入的稀盐酸恰好与碳酸钠完全反应。设样品中碳酸钠的质量为x,生成氯化钠的质量为y,二氧化碳的质量为z。 Na2CO3 +...查看答案和解析>>
科目:初中化学 来源:山东省青岛市2018年中考化学试卷 题型:多选题
下列图像能正确反映其对应关系的是
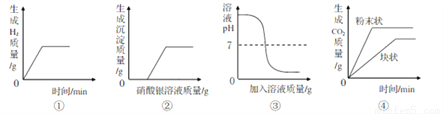
A. ①表示向一定量的稀硫酸中加入足量的锌粒
B. ②表示向一定量稀盐酸和氯化钡的混合液中滴加硝酸银溶液
C. ③表示向一定量的氢氧化钠溶液中滴加稀硫酸
D. ④表示将等质量的大理石分别与足量的等体积等溶质质量分数的稀盐酸反应
AC 【解析】A、向一定量的稀硫酸中加入足量的锌粒时,反应生成氢气,当稀硫酸完全反应后不再产生气体,正确;B、向一定量稀盐酸和氯化钡的混合液中滴加硝酸银溶液时,立即产生白色沉淀,错误;C、向一定量的氢氧化钠溶液中滴加稀硫酸时,氢氧化钠和稀硫酸反应生成硫酸钠和水,随着反应进行,pH不断减小,恰好完全反应时pH=7,继续加入稀硫酸时pH小于7,正确;D、将等质量的大理石分别与足量的等体积等溶质质...查看答案和解析>>
科目:初中化学 来源:山东省青岛市2018年中考化学试卷 题型:单选题
根据图中提供的信息判断,下列说法正确的是
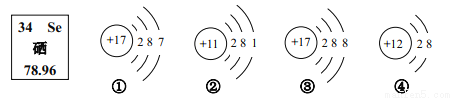
A. ③④属于同种元素
B. ②表示的元素在形成化合物时化合价为+1 价
C. ①③的化学性质相似
D. 硒元素的相对原子质量为 78.96 g
B 【解析】A、质子数决定元素的种类,③④核内质子数不相同,不属于同种元素,错误;B、化合价的数值等于离子所带电荷的数值,且符号一致;题干②图是钠原子失去1个电子得到的,带1个单位的正电荷,钠元素在形成化合物时的化合价为+1,正确。C、最外层电子数决定元素的化学性质,①③的最外层电子数不同,化学性质不相似,错误;D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子...查看答案和解析>>
科目:初中化学 来源:重庆市2018年中考化学试卷(A卷) 题型:简答题
2018年5月13日,我国首艘001A型国产航母开始海试,标志着我国在航海及军事领域取得重大突破。根据所学知识填空。
(1)建造航母用到了钛合金,构成金属钛的粒子是________(填“原子”“分子”或“离子”),工业制钛有一种反应为:TiF4+2H2SO4 4HF+2X+TiO2,X 的化学式为_______。
4HF+2X+TiO2,X 的化学式为_______。
(2)航母外壳用涂料覆盖,是为了防止钢铁材料与_______________接触而锈蚀。
(3)为了探究航母材料中锌、铁、铜三种金属活动性强弱,某同学设计了下列实验(每步均充分反应),其中能达到目的是________________(填序号)。
A.稀盐酸中加入足量铁粉后,再加铜粉,最后加入锌粉
B.ZnCl2溶液中加入足量铁粉后,再加入CuCl2溶液
C.ZnCl2溶液中加入足量铜粉后,再加入铁粉
原子 SO3 水和氧气 AB 【解析】本题主要考查了质量守恒定律,金属锈蚀的原理,探究金属的活动性顺序等。难度不大,根据已有的知识进行分析解答。 (1)金属是由原子直接构成,构成金属钛的粒子是原子;根据TiF4+2H2SO44HF+2X+TiO2可知,反应物中有1个钛原子,4个氟原子,4个氢原子,2个硫原子,8个氧原子,生成物中有4个氢原子,4个氟原子,1个钛原子,2个氧原子和2X;根...查看答案和解析>>
科目:初中化学 来源:广东省2018年中考化学试卷 题型:简答题
下图为两物质的溶解度曲线。请回答:
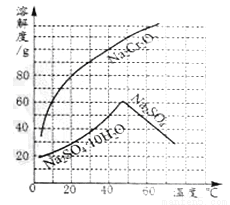
(1)50℃时,Na2Cr2O7的溶解度为______g;60℃时溶解度:Na2Cr2O7_______Na2SO4(填“<”、“=”、“>”)。
(2)在50℃时,把210gNa2Cr2O7饱和溶液降温到10℃时,析出Na2Cr2O7______g (假设不含结晶水)。
110 > 50 【解析】根据溶解度曲线分析解答。(1)由溶解度曲线可知,50℃时,Na2Cr2O7的溶解度为110g;由溶解度曲线可知,60℃时溶解度:Na2Cr2O7>Na2SO4;(2)由溶解度曲线可知,50℃时,Na2Cr2O7的溶解度为110g;10℃时,Na2Cr2O7的溶解度为60g。在50℃时,把210gNa2Cr2O7饱和溶液降温到10℃时,析出Na2Cr2O750g。 ...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com