
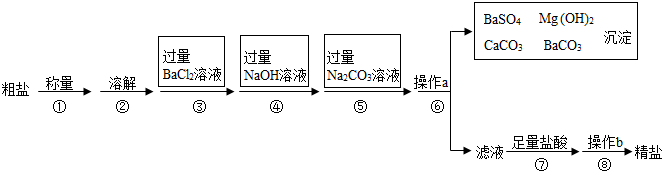
分析 根据托盘天平的使用、氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠、碳酸钠能与氯化钙和氯化钡反应、盐酸能与氢氧化钠和碳酸钠反应以及过滤操作的注意事项、结晶方法选择的原理进行分析解答即可.
解答 解:(1)用托盘天平称量粗盐时,若指针偏向右边,说明左盘轻,砝码重,故填:D;
(2)第④步操作是氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,发生反应的化学方程式是2NaOH+MgCl2═Mg(OH)2↓+2NaCl,故填:2NaOH+MgCl2═Mg(OH)2↓+2NaCl.
(3)第⑤步操作加入过量的碳酸钠溶液,能除去氯化钙和过量的氯化钡,故其目的是除去氯化钙和过量的氯化钡,故填:除去氯化钙和过量的氯化钡.
(4)第⑥步操作得到的不溶性固体和溶液,故a的名称是过滤,该操作中,有可能影响操作效果的原因可能是液面高于滤纸边缘,故填:过滤,液面高于滤纸边缘;
(5)在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去过量的碳酸钠和氢氧化钠,故填:除去碳酸钠和氢氧化钠.
(6)在第⑧步操作是蒸发,由于氯化钠的溶解度受温度影响变化不大,故选用蒸发结晶的方法,故根据的原理是氯化钠的溶解度受温度影响变化不大,故填:氯化钠的溶解度受温度影响变化不大.
点评 本题以海水中粗盐提纯为知识背景,考查了常见仪器的使用、化学方程式的书写、物质的性质以及溶解度的知识,完成此题,可以依据已有的知识进行.


科目:初中化学 来源: 题型:选择题
| A. | 它们都属于混合物 | |
| B. | 目前我市公交车、出租车都有CNG标志,这类车都是以天然气为燃料,可减轻对空气污染 | |
| C. | 它们蕴藏量有限,是人们可利用的唯一能源,非常宝贵 | |
| D. | 直接燃烧石化燃料既污染环境,又浪费资源 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
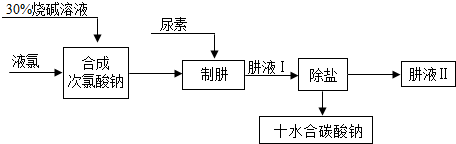
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一定含碳、氢、氧三种元素 | B. | 一定只含氧元素 | ||
| C. | 一定含碳元素和氢元素 | D. | 一定不含氧元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳能形成多种单质,如:金刚石、石墨、C60等.碳具有还原性,用焦炭可冶炼铁 | |
| B. | SO3、CO2、CO是非金属氧化物,都可用NaOH溶液吸收 | |
| C. | C、CO、CH4、C2H2OH均能作为燃料使用 | |
| D. | 铁是化学性质比较活泼的金属,除与氧气反应外,还能与某些酸和盐溶液发生置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量的该漂白液加入到烧杯中,再放入有色布条 | 一段时间后,有色布条没有变化 | 该漂白液已完全失效 |
| 实验操作及实验现象 | 实验结论 |
| 取少量该漂白液于试管中,加入过量的稀盐酸.观察到有气泡产生 | 猜想①不合理 |
| 取一定量的漂白液于试管中,加入过量的CaCl2溶液使Na2CO3完全反应,静置后向上层清液中滴加酚酞溶液,无明显变化 | 猜想③不合理,②合理 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
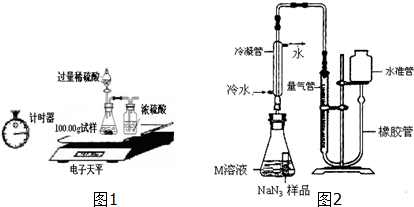
| 称量项目 | 称量时间 | 质量(g) |
| 试样 | 100.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 339.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 339.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 339.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com