
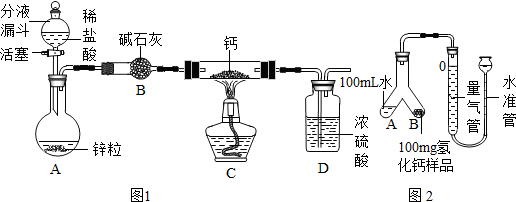
分析 【氢化钙的制备】
(1)碱石灰能够吸收氯化氢气体和水蒸气;
浓硫酸能够吸收水;
(2)实验要按照一定的顺序进行;
(3)根据反应物、生成物、反应条件及其质量守恒定律可以书写反应的化学方程式;
显碱性的溶液能使酚酞试液变红色;
【产品的定量测定】
凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
(5)量气管中液面不再变化时,说明样品与水完全反应;
(6)两次的体积差即为反应生成氢气的体积;
(7)根据反应的化学方程式和提供的数据可以进行相关方面的计算;
(8)根据具体的操作可以判断相关方面的问题.
解答 解:(1)装置B的作用是吸收水蒸汽和氯化氢气体;
装置D的作用是防止空气中的水蒸气进入C装置.
故填:吸收水蒸汽和氯化氢气体;防止空气中的水蒸气进入C装置.
(2)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,收集气体并检验其纯度,加热反应一段时间,停止加热,充分冷却,关闭分液漏斗活塞.
故填:②①④③.
(3)①CaH2与水反应的化学方程式为:CaH2+2H2O═Ca(OH)2+2H2↑;
②该同学的判断不正确,原因是钙也能与水反应生成氢氧化钙和氢气,溶液也能使酚酞变红.
故填:CaH2+2H2O═Ca(OH)2+2H2↑;钙也能与水反应生成氢氧化钙和氢气,溶液也能使酚酞变红.
【产品的定量测定】
①检查装置气密性,方法是:在量气管中加入适量的水,上下移动水准管,如果静止一段时间后能够产生液面差,说明装置不漏气.
故填:在量气管中加入适量的水,上下移动水准管,如果静止一段时间后能够产生液面差,说明装置不漏气.
④将Y型管中水与氢化钙样品混合,操作为:将Y形管慢慢倾斜,直至A中的水与B中样品相混合.
故填:将Y形管慢慢倾斜,直至A中的水与B中样品相混合.
⑤反应结束,冷却至室温,再次调节量气管与水准管液面相平,读取液面所在刻度数据为110.0mL.
故填:调节量气管与水准管液面相平.
(5)判断样品与水完全反应的方法是:量气管中液面不再变化.
故填:量气管中液面不再变化.
(6)反应生成氢气的体积为:110.0mL-10.0mL=100.0mL.
故填:100.0.
(7)设氢化钙的质量为x,和水反应生成氢气的质量为y,
反应生成氢气质量为:0.09mg/mL×100.0mL=9mg,
CaH2+2H2O═Ca(OH)2+2H2↑,Ca+2H2O═Ca(OH)2+H2↑,
42 4 40 2
x y 100mg-x 9mg-y
$\frac{42}{x}$=$\frac{4}{y}$,$\frac{40}{100mg-x}$=$\frac{2}{9mg-y}$,
x=88.4mg,
样品中氢化钙的纯度为:$\frac{88.4mg}{100mg}$×100%=88.4%,
答:样品中氢化钙的纯度为88.4%.
(8)①Y型管中残留有氢气时,对测定结果没有影响.
故填:准确.
②未冷却至室温即读数,会导致测定的氢气体积偏大,从而导致测定结果偏大.
故填:偏大.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 电解水 H2O═H2+O2 | |
| B. | 铁和稀盐酸反应 2Fe+6HCl═2FeCl3+3H2↑ | |
| C. | 实验室制二氧化碳 CaCO3+H2SO4═CaSO4+CO2↑+H2O | |
| D. | 氢氧化钠溶液与稀硫酸反应 2NaOH+H2SO4═Na2SO4+2H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
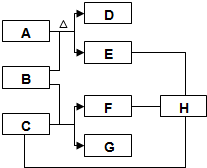 A、B、C、D、E、F、G、H为初中化学中常见的物质,其中A和E是组成元素相同的两种气体,框图中体现了H的三种不同化学性质.
A、B、C、D、E、F、G、H为初中化学中常见的物质,其中A和E是组成元素相同的两种气体,框图中体现了H的三种不同化学性质. 查看答案和解析>>
科目:初中化学 来源: 题型:选择题
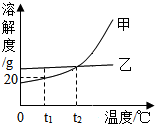 甲、乙两种不含结晶水的固体物质的溶解度曲线如图,下列说法正确的是( )
甲、乙两种不含结晶水的固体物质的溶解度曲线如图,下列说法正确的是( )| A. | 甲的溶解度比乙大 | |
| B. | t2℃时,甲、乙的两种溶液中溶质的质量分数相等 | |
| C. | t1℃时,将50 g水加入15 g甲物质中,可得到65 g溶液 | |
| D. | 要使接近饱和的乙溶液转化为饱和溶液,可采用蒸发溶剂的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 编号 | 物质 | 杂质 | 试剂 | 除杂操作方法 |
| A | CO2 | CO | 点燃 | |
| B | NaCl | KNO3 | 水 | 溶解、过滤、蒸发 |
| C | NaNO3 | Na2CO3 | 适量CaCl2溶液 | 过滤 |
| D | Cu | CuO | 过量盐酸 | 过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 不少同学都被蚊虫叮咬过,感觉双痛双痒.同学们从化学课上知道:蚊虫叮咬时能在人的皮肤内分泌出蚁酸CH2O2刺激皮肤.课外兴趣小组同学决定对蚁酸进行探究.
不少同学都被蚊虫叮咬过,感觉双痛双痒.同学们从化学课上知道:蚊虫叮咬时能在人的皮肤内分泌出蚁酸CH2O2刺激皮肤.课外兴趣小组同学决定对蚁酸进行探究.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
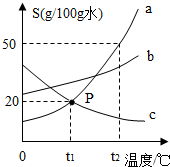 如图为a、b、c三种物质(均不含结晶水)的溶解度曲线.
如图为a、b、c三种物质(均不含结晶水)的溶解度曲线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com