

·ÖĪö £Ø1£©øł¾ŻĪļĄķ±ä»ÆŗĶ»Æѧ±ä»ÆµÄĒų±šĄ“½ā“šøĆĢā£»
øł¾Żµē½āĖ®µÄŹµŃé½įĀŪĄ“ŹéŠ“ĪÄ×Ö±ķ“ļŹ½£¬²¢øł¾ŻĘųĢåµÄŠŌÖŹĄ“Ķź³ÉÅŠ¶Ļ£»
øł¾ŻĖ®µÄ¾»»Æ¹ż³ĢĄ“·ÖĪöÅŠ¶Ļ£»
£Ø2£©øł¾ŻĖ®µÄĪŪČ¾Ō“·ÖĪöÅŠ¶Ļ£»
£Ø3£©øł¾ŻæÕĘųµÄ³É·Ö¼°ø÷³É·ÖµÄŠŌÖŹ·ÖĪö»Ų“š£»
£Ø4£©øł¾Ż±£»¤Ė®×ŹŌ“µÄĶ¾¾¶½ųŠŠ·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©øł¾ŻĶ¼ÖŠæÉŅŌµĆ³öøĆ¹ż³ĢŹĒĖ®µÄ·ŠĢŚ£¬ŌŚÕāøö¹ż³ĢÖŠĖ®ÓÉŅŗĢ¬±ä³ÉĘųĢ¬£¬ŌŚŹŌ¹ÜæŚÓÖ±ä³ÉŅŗĢ¬£¬½öŹĒĖ®µÄדĢ¬µÄ±ä»Æ£¬Ć»ÓŠ²śÉśŠĀµÄĪļÖŹ£¬ĖłŅŌŹōÓŚĪļĄķ±ä»Æ£»
µē½āĖ®µÄŹµŃéÖŠ£¬Õż¼«µĆµ½µÄŹĒŃõĘų£¬¶ųøŗ¼«µĆµ½µÄŹĒĒāĘų£¬¼“1¹ÜÖŠµÄĘųĢåŹ±ĒāĘų£¬Ė®ĶصēÉś³ÉĒāĘųŗĶŃõĘų£¬øĆŹµŃéĖµĆ÷Ė®ÓÉĒāŌŖĖŲŗĶŃõŌŖĖŲ×é³É£»øł¾ŻĖ®µÄ¾»»Æ¹ż³Ģ¼°·½·ØæÉŅŌÖŖµĄŠ”ĀŃŹÆŗĶŹÆӢɳµÄ×÷ÓĆĪŖ¹żĀĖ³ö²»ČÜÓŚĖ®µÄŌÓÖŹ£»»īŠŌĢæµÄ×÷ÓĆŹĒĪüø½£¬ÓĆ“Ė×°ÖĆ¾»»ÆŗóµĆµ½µÄĖ®ŹōÓŚ»ģŗĻĪļ£¬ŅņĪŖĖ®ÖŠŗ¬ÓŠæÉČÜŠŌĪļÖŹ£»
£Ø2£©£©¢ŁŌŚŅżĖ®Ēž°¶±ß¶Ń·ÅĄ¬»ų£¬»įŌģ³ÉĖ®µÄĪŪČ¾£»
¢ŚĻņŅżĖ®ĒžÖŠÅŷŹ¤Ņµ·ĻĖ®£¬»įŌģ³ÉĖ®µÄĪŪČ¾£»
¢ŪŌŚŅżĖ®ĒžĮ½°¶Ö²Ź÷£¬Äܱ£»¤Ė®ĶĮ£»
¢ÜĻņŅżĖ®ĒžÖŠĒćµ¹Éś»īĪŪĖ®£¬»įŌģ³ÉĖ®µÄĪŪČ¾£®
£Ø3£©Ė®ÕōĘųÓöĄäĄäÄż³ÉŅŗĢ壬ĻÄĢģ£¬Ź¢·Å±ł°ōµÄ±×ÓĶā±ŚÉĻø½ÓŠŅ»²ćĖ®Ö飬ĖµĆ÷æÕĘųÖŠŗ¬ÓŠĖ®ÕōĘų£®
£Ø4£©½ŚĖ®µÄ“ėŹ©°üĄØ£¬Ņ»·½ĆęŅŖ½ŚŌ¼ÓĆĖ®£¬ĮķŅ»·½ĆęŅŖ·ĄÖ¹Ė®ĢåĪŪČ¾£¬¹Ź“š°øĪŖ£ŗÓĆĻ“²ĖĢŌĆ×µÄĖ®½½»Ø£Ø»ņÓĆĻ“ŅĀ·žµÄĖ®³åĻ“ĀķĶ°µČ£©
¹Ź“š°øĪŖ£ŗ£Ø1£©ĪļĄķ£»ĒāĘų£»ĒāŌŖĖŲŗĶŃõŌŖĖŲ£»³żČ„²»ČÜŠŌµÄŌÓÖŹ£»Īüø½£»»ģŗĻĪļ£»
£Ø2£©¢Ł¢Ś¢Ü£»
£Ø3£©Ė®ÕōĘų£»
£Ø4£©ÓĆĻ“²ĖĢŌĆ×µÄĖ®½½»Ø£Ø»ņÓĆĻ“ŅĀ·žµÄĖ®³åĻ“ĀķĶ°µČ£©£®
µćĘĄ “ĖĄąĢāŅ»°ćÄŃ¶Č½ĻŠ”£¬ŌŚ½ā“ĖĄąĢāŹ±£¬Ź×ĻČÅŖĒåĪŹĢāæ¼²éµÄÖŖŹ¶µć£¬Č»ŗó½įŗĻĖłŃ§µÄÖŖŹ¶½ųŠŠ·ÖĪö£®


 Ļ°Ģā¾«Ń”ĻµĮŠ“š°ø
Ļ°Ģā¾«Ń”ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢ½¾æĢā
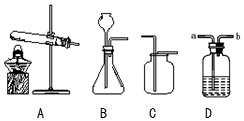 øł¾ŻČēĶ¼ĖłŹ¾×°ÖĆ»Ų“šĪŹĢā£®
øł¾ŻČēĶ¼ĖłŹ¾×°ÖĆ»Ų“šĪŹĢā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na+”¢Cl-”¢H+”¢CO32- | B£® | Ag+”¢Ca2+”¢NO3-”¢Cl- | ||
| C£® | NO3-”¢OH-”¢Cu2+”¢Na+ | D£® | K+”¢Mg2+”¢Cl-”¢NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| Ćæ100gŗ¬ÓŠ ÓŖŃų³É·Ö | ĢĒĄą | ÓĶÖ¬ | µ°°×ÖŹ | Ī¬ÉśĖŲC | øĘ | Ć¾ | ÄĘ | Šæ |
| 7.6g | 7.8g | 7.4g | 18mg | 201mg | 18.2mg | 30.8mg | 8.1mg |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
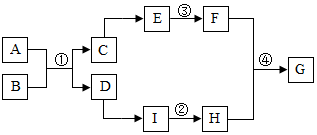 A”«I¶¼ŹĒ³õÖŠ»Æѧ֊³£¼ūµÄĪļÖŹ£¬ŅŃÖŖ£¬AŹĒŅ»ÖÖĪŽÉ«ĪŽĪ¶µÄĘųĢ壬CŹĒÓ¦ÓĆ×ī¹ć·ŗµÄ½šŹō£¬IŹĒ½ØÖž²ÄĮĻµÄÖ÷ŅŖ³É·Ö£¬FŹĒŹµŃéŹŅ³£ÓƵÄČܼĮ£¬ĖüĆĒµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĘäĖüÓŠ¹ŲĪļÖŹĪ“ĮŠ³ö£®ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©
A”«I¶¼ŹĒ³õÖŠ»Æѧ֊³£¼ūµÄĪļÖŹ£¬ŅŃÖŖ£¬AŹĒŅ»ÖÖĪŽÉ«ĪŽĪ¶µÄĘųĢ壬CŹĒÓ¦ÓĆ×ī¹ć·ŗµÄ½šŹō£¬IŹĒ½ØÖž²ÄĮĻµÄÖ÷ŅŖ³É·Ö£¬FŹĒŹµŃéŹŅ³£ÓƵÄČܼĮ£¬ĖüĆĒµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĘäĖüÓŠ¹ŲĪļÖŹĪ“ĮŠ³ö£®ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©| A£® | ĻņĪļÖŹGµÄĖ®ČÜŅŗÖŠµĪČėĪŽÉ«·ÓĢŖŹŌŅŗ£¬ČÜŅŗ±äŗģÉ« | |
| B£® | ¢ŚŗĶ¢ŪµÄ»Æѧ·“Ó¦ĄąŠĶĻąĶ¬ | |
| C£® | ·“Ó¦¢ŚŹĒĪüČČ·“Ó¦£¬·“Ó¦¢ÜŹĒ·ÅČČ·“Ó¦ | |
| D£® | ĪļÖŹAŗĶĪļÖŹE¶¼¾ßÓŠæÉČ¼ŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
| Ö÷Ź³ | Ć×·¹”¢ĀųĶ· |
| ø±Ź³ | ÉÕ¼¦æ锢ĻĢŃ¼µ°”¢ŗģÉÕÓć”¢»ØÉśĆ× |
| ŅūĮĻ | Å£ÄĢ |
| ÄćµÄ²¹³ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚĶŠÅĢÉĻµęÖ½³ĘĮæ12 g NaOH¹ĢĢå | |
| B£® | ³ĘĮæŹ±·¢ĻÖÖøÕėĻņÓŅĘ«×Ŗ£¬Ó¦µ÷½ŚÓĪĀėŹ¹ĢģĘ½Ę½ŗā | |
| C£® | ÓĆ100 mLĮæĶ²ĮæČ”88 mLĖ® | |
| D£® | ÓĆŅ©³×½Į°č£¬¼ÓĖŁNaOHČܽā |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com