
| 清洁产品 | 除垢净 | 去污粉 | 管道通 |
| 主要成分 | 盐酸 | 碳酸钠 | 氢氧化钠、铝粉 |
分析 (1)除垢净的成分是盐酸,会与铁发生反应;
(2)去污粉与除垢净不能混合使用,会发生反应;
(3)NaOH具有强烈的腐蚀性,使用时不能接触皮肤;根据化合物中化合价代数和为零计算.
解答 解:(1)除垢净的成分是盐酸,会与铁发生反应;
(2)去污粉与除垢净不能混合使用,会发生反应,化学方程式为:Na2CO3+2HCl═2NaCl+CO2↑+H2O;
(3)NaOH具有强烈的腐蚀性,使用时不能接触皮肤;单质种元素化合价为零,化合物中化合价代数和为零,故铝元素的化合价变化为0~+3价.
故答案为:(1)铁与稀盐酸会发生反应;
(2)Na2CO3+2HCl═2NaCl+CO2↑+H2O
(3)NaOH具有强烈的腐蚀性;0~+3.
点评 本题难度不大,可依据已有的知识解答.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
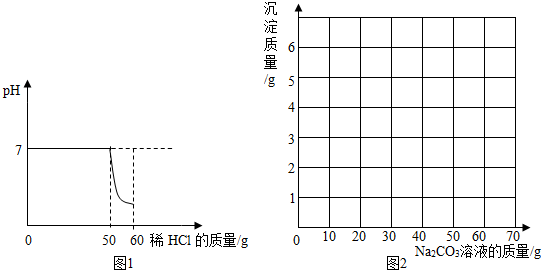
| Na2CO3溶液质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 沉淀质量/g | 0 | 1 | n | 3 | 4 | 5 | m |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
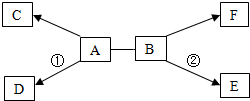 A-F是初中化学常见的六种物质,已知A广泛用于造纸、玻璃、洗涤剂生产等工业,C和F都是无色气体,且F是单质,反应①和②都有白色沉淀生成.它们之间的关系如图所示(“→”表示物质间的转化关系,“-”表示两种物质能相互反应;部分反应物、生成物及反应条件未标出).请回答下列问题:
A-F是初中化学常见的六种物质,已知A广泛用于造纸、玻璃、洗涤剂生产等工业,C和F都是无色气体,且F是单质,反应①和②都有白色沉淀生成.它们之间的关系如图所示(“→”表示物质间的转化关系,“-”表示两种物质能相互反应;部分反应物、生成物及反应条件未标出).请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
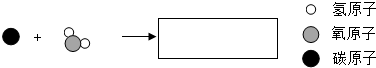
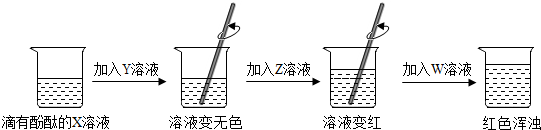
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
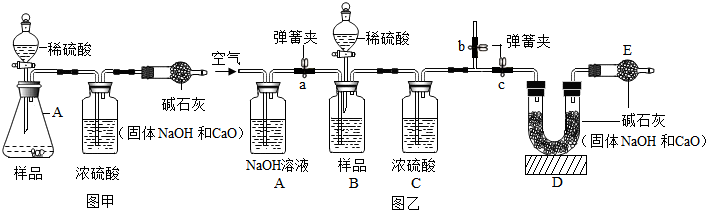
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
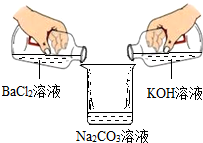 学习完盐的化学性质以后,同学们做了一个趣味实验.如图所示,它们在倾倒过程中观察到烧杯左侧的无色溶液中产生了白色沉淀.倾倒并经过沉降后,他们对最终烧杯内上层清液中所含有的离子展开了探究.
学习完盐的化学性质以后,同学们做了一个趣味实验.如图所示,它们在倾倒过程中观察到烧杯左侧的无色溶液中产生了白色沉淀.倾倒并经过沉降后,他们对最终烧杯内上层清液中所含有的离子展开了探究.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com