
| A. | 铁、碘、钙是人体必需的微量元素 | |
| B. | 焚烧秸秆或增加空气中的PM2.5 | |
| C. | 服用含Al(OH)3的药物可治疗胃酸过多 | |
| D. | 洗涤剂具有乳化作用能去除油污 |
科目:初中化学 来源: 题型:填空题
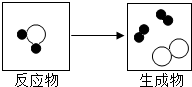 如图是某反应的微观粒子示意图.
如图是某反应的微观粒子示意图. B.两个
B.两个 C.一个
C.一个 D.两个
D.两个
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
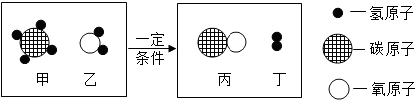
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

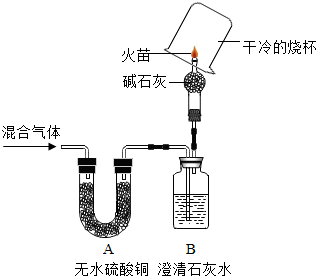
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 胃酸过多可服用适量的小苏打 | |
| B. | 油锅着火可以立即用冷水浇灭 | |
| C. | 食用加碘食盐可预防甲状腺肿大 | |
| D. | 水中的色素和异味可以用活性炭除去 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量样品溶于水,加入过量Ca(NO3)2的溶液 | 产生白色沉淀 | 该反应的化学方程式:Ca(NO3)2+Na2CO3═2NaNO3+CaCO3↓ |
| ②将上述反应后的混合液过滤,取滤液 加过量的稀硝酸 | 有气泡产生 | 该反应的方程式: NaHCO3+HNO3═NaNO3+H2O+CO2↑ |
| ③取②反应后的溶液,加入 硝酸银溶液 | 产生白色沉淀 | 证明猜想(4)成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com