
| 称量项目 | 称量时间 | 质量(g) |
| 试样 | 100.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 339.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 339.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 339.00 |
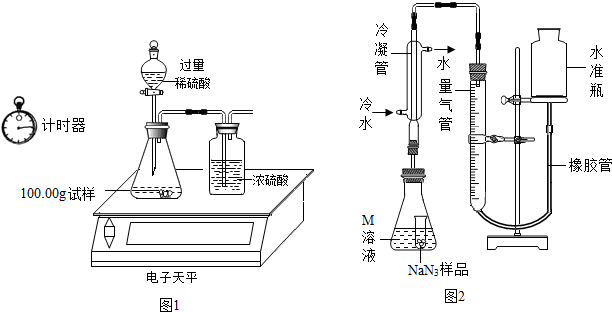
分析 【查阅资料】:
①根据信息判断反应物、生成物、反应条件,然后写出方程式;
④根据质量守恒定律的实质来判断X的化学式,再根据气体的酸碱性考虑;
【问题探究】:
(一)
(1)氢氧化钠和空气中的二氧化碳反应反应生成碳酸钠,据此回答;
(2)①从题目中给出的反应原理进行分析解答;
②根据C装置的浓硫酸干燥CO2气体,若无C装置会使实验结果偏大解答;
③根据表中信息可知:反应前后减少的质量为生成的二氧化碳的质量,利用生成的二氧化碳的质量和化学方程式Na2CO3+H2SO4=Na2SO4+H2O+CO2↑计算出样品中碳酸钠的质量,然后根据质量分数公式便可计算出样品中纯碱的质量分数.
(二)
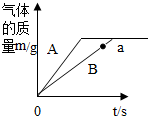
(1)根据出现液面差后,如装置严密,装置内的气压不变的情况回答.
(2)反应可能产生水蒸气,使用冷水冷凝可除去生成的气体中的水蒸气;
(3)量取体积时,量筒的量程要和所测体积相近,且只能一次量出.
(4)先根据体积和密谋计算氮气的体积,再利用关系式2NaN3→3N2计算NaN3样品的纯度.
解答 解:(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑;
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X的化学式为:NH3,氨气溶于水形成的氨水显碱性,能使湿润的红色石蕊试纸变蓝,使无色酚酞试液变红色,所以可以用无色酚酞试纸或红色石蕊试纸检测;
【问题探究】:
(1)工业级NaN3中常含有少量的Na2CO3,其原因是氢氧化钠和空气中的二氧化碳反应反应生成碳酸钠,故答案为:2NaOH+CO2═Na2CO3+H2O
(2)①锥形瓶中发生的反应方程式:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
②C装置的浓硫酸干燥CO2气体,若无C装置会使实验结果偏大;
③根据表中信息可知:反应前后减少的质量为生成的二氧化碳的质量,二氧化碳的质量=100.00g+241,20g-339.00g=2.2g
设样品中碳酸钠的质量是x.
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 2.2g
$\frac{106}{x}=\frac{44}{2.2g}$
x=5.3g
碳酸钠的质量分数为:$\frac{5.3g}{100g}×$100%=5.3%
(二)
(1)连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,如装置严密,装置内气压不变,两边高度差不变;
(2)反应可能产生水蒸气,使用冷水冷凝的目的是除去生成的气体中的水蒸气.
(3)量取体积时,量筒的量程要和所测体积相近,且只能一次量出,所以选100mL的量筒.
(4)生成氮气的质量为67.2mL÷1000mL/L×1.25g/L=0.084g.
设NaN3样品的纯度X
2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
130 84
X•0.140g 0.084g
$\frac{130}{X×0.140g}=\frac{84}{0.084g}$
解得:X=92.86%
答案:
(一)①2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑;④NH3,
【问题探究】:
(一)(1)2NaOH+CO2═Na2CO3+H2O; (2)①Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;②偏大;③5.3%
(二)
(1)左右两边出现稳定的液面差;
(2)使水蒸气液化(或除去水蒸气);
(3)A;
(4)92.9%.
点评 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,对这类题目要重点训练.


科目:初中化学 来源: 题型:选择题
| A.化学与生活 | B.化学与环境 |
| ①用灼烧的方法能鉴别尼龙线和羊毛线 ②活性炭能净水是因为活性炭有吸附性 | ①酸雨主要是由CO2、SO2气体引起的 ②PM2.5是造成雾霾天气的“元凶”之一 |
| C.化学与健康 | D.化学与安全 |
| ①发霉的谷物晾晒后即可食用 ②使用加铁酱油可预防贫血 | ①酒精洒在桌上不慎燃烧起来,可以用水浇灭 ②误服重金属盐溶液,喝鸡蛋清或牛奶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
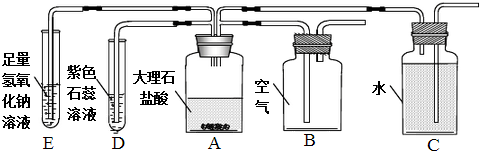
 A、B为碳酸钙块状固体和碳酸钠粉末中的某一种,在两烧杯中分别放入质量为16g的A、B两种物质,各加入109.5g溶质质量分数相同的稀盐酸,充分反应,反应产生气体的质量与反应时间的关系如图所示.
A、B为碳酸钙块状固体和碳酸钠粉末中的某一种,在两烧杯中分别放入质量为16g的A、B两种物质,各加入109.5g溶质质量分数相同的稀盐酸,充分反应,反应产生气体的质量与反应时间的关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 石墨转化为金刚石是由于原子种类改变 | |
| B. | Na和Na+属于同种元素是由于电子数相同 | |
| C. | CO2和CO的化学性质不同是由于分子间隔不同 | |
| D. | FeCl3、Fe2(SO4)3溶液都能与NaOH溶液发生类似反应,是因为所含阳离子相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①是化合反应 | B. | ②是分解反应 | C. | ③是置换反应 | D. | ④是复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 选择自行车和公交车作为出行工具 | |
| B. | 大量使用一次性塑料袋 | |
| C. | 公交车使用液化天然气、乙醇等清洁燃料 | |
| D. | 拒绝使用一次性木筷,用电子贺卡代替纸质贺卡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com