
(7分)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5 g化肥样品与足量浓烧碱溶液加热,产生的氨气用100.0g废硫酸吸收。测得吸收氨气的溶液总质量m与反应时间t的变化如下图所示。所涉及的反应为:
(NH4)2SO4+2NaOH===Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4 == (NH4)2SO4 。
请计算:

(1)完全反应后产生氨气 g。
(2)该化肥的含氮量为 (精确到0.1%),则这种化肥属于 (填:“合格”或“不合格”。合格硫酸铵含氮量为20%以上)产品。
(3)请计算废硫酸中硫酸的质量分数(写出计算过程)。
(4)若实验过程中氨气被完全吸收,但该实验测得硫酸铵化肥的含氮量高于实际值,其原因是 。
(1)(1分)6.8g
(2)(2分)20.4% 合格
(3)解:设废硫酸中纯硫酸的质量为x 。
2NH3 + H2SO4 == (NH4)2SO4,
34 98
6.8g x .........................................(1分)
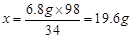
..................................(1分)
H2SO4%=(19.6g÷100.0g)×100%=19.6% ............................(1分)
答:废硫酸中硫酸的质量分数为19.6%。
(4)(1分)加热反应产生的水蒸汽被废硫酸吸收,导致所测吸收液质量比只吸收氨气大。
【解析】略


 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:初中化学 来源: 题型:
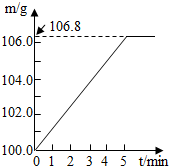 某同学为了检验家里购买的硫酸铵化肥是否合格,称取了27.5g化肥样品与足量浓烧碱溶液一起加热,产生的氨气用足量的100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如右图所示.已知合格硫酸铵化肥中含氮量不低.20%.所涉及的反应为(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑;2NH3+H2SO4=(NH4)2SO4.试计算:
某同学为了检验家里购买的硫酸铵化肥是否合格,称取了27.5g化肥样品与足量浓烧碱溶液一起加热,产生的氨气用足量的100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如右图所示.已知合格硫酸铵化肥中含氮量不低.20%.所涉及的反应为(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑;2NH3+H2SO4=(NH4)2SO4.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2011?和平区二模)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氮气用100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如图所示,所涉及的反应为:(NH4)SO4+2NaOH=Na2SO4+2NH3+2H2O↑;2NH3+H2SO4=(NH4)SO4.请计算:(1)完全反应后产生氨气
(2011?和平区二模)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氮气用100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如图所示,所涉及的反应为:(NH4)SO4+2NaOH=Na2SO4+2NH3+2H2O↑;2NH3+H2SO4=(NH4)SO4.请计算:(1)完全反应后产生氨气查看答案和解析>>
科目:初中化学 来源: 题型:
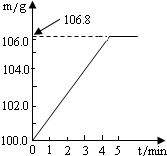
 某同学为了检验家里购买的硫酸铵化肥是否合格,称取了27.5g化肥样品与足量浓烧碱溶液一起加热,产生的氨气用足量的100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如右图所示.已知合格硫酸铵化肥中含氮量不低于20%.所涉及的反应为(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑;2NH3+H2SO4=(NH4)2SO4.试计算:
某同学为了检验家里购买的硫酸铵化肥是否合格,称取了27.5g化肥样品与足量浓烧碱溶液一起加热,产生的氨气用足量的100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如右图所示.已知合格硫酸铵化肥中含氮量不低于20%.所涉及的反应为(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑;2NH3+H2SO4=(NH4)2SO4.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com