解:(1)第二次加入稀盐酸后“烧杯+剩余物质”质量为:175.6g+30g-4.4g=201.2g.故答案为:201.2
(2)反应中产生的二氧化碳气体质量为50g+100g+150g-280.2g=19.8g
设50g贝壳样品中碳酸钙的质量为x
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 44
x 19.8g
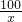
=
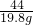
x=45g
贝壳样品中碳酸钙的质量:
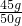
×100%=90%
答:贝壳样品中碳酸钙的质量分数是90%.
(3)第三次实验后产生的二氧化碳气体质量为13.2g
设消耗碳酸钙的质量为z,产生氯化钙的质量为y
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 111 44
z y 13.2g

=
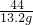
=
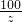
y=33.3g z=30g
溶液中溶质的质量分数:

×100%=31.2%
答:溶液中溶质的质量分数31.2%.
分析:(1)分析实验过程中的数据记录,第一次加入稀盐酸30克时,烧杯+剩余物质质量减少4.4g,则可判断每加入稀盐酸30克则烧杯+剩余物质质量减少4.4g,推断第二次加入稀盐酸后烧杯+剩余物质质量质量;
(2)由第五次加入稀盐酸30克时,烧杯+剩余物质质量减少2.2g的实验数据,可判断此时碳酸钙已完全反应,剩余固体为样品中的杂质,由此可计算石灰石样品中碳酸钙的质量分数;
(3)根据质量守恒定律,烧杯中物质充分反应后所得溶液的质量=所加稀盐酸的质量+参加反应的碳酸钙质量-放出二氧化碳的质量.
点评:分析实验所记录的数据时,注意数据变化量间的规律,利用变化规律判断完全反应时所涉及物质的质量.

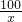 =
=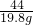
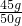 ×100%=90%
×100%=90% =
=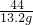 =
=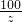
 ×100%=31.2%
×100%=31.2%

