
| A.实验失败后重新再做 |
| B.得到较多的数据 |
| C.避免偶然现象,使结果更真实 |
| D.得出不同的结论 |
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:初中化学 来源: 题型:阅读理解
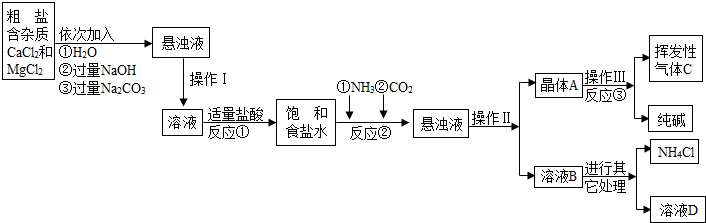
| ||
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 工业纯碱标准:(Na2CO3≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| 工业纯碱标准:(Na2CO3%》) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象 | 实验结论 |
| ①从甲同学的烧杯中取少量上层清液于试管中,向其中滴加足量CaCl2溶液. | 有白色沉淀生成 |
生成白色沉淀的化学方程式为: CaCl2+Na2CO3=CaCO3↓+2NaCl CaCl2+Na2CO3=CaCO3↓+2NaCl . |
| ②过滤,向滤液中滴加无色酚酞溶液. | 不变红色 不变红色 |
通过实验及分析,样品中只含有: 碳酸钠和碳酸钙. |

查看答案和解析>>
科目:初中化学 来源:期末题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com