
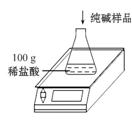
工业上侯氏制碱法制得的纯碱产品中常含有少量的氯化钠杂质,化验员要对每批次的纯碱产品进行检验。在实验室中取27 g纯碱样品,平均分成五份依次加入到盛有100 g稀盐酸的锥形瓶中(锥形瓶的质量为60 g),每次充分反应后都进行称量,得到的实验数据如下表:
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样 品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 电子天平 的示数/g | 163.2 | 166.4 | 169.6 | 175 | 180.4 |
(1)第一次加入纯碱样品充分反应后,生成二氧化碳的质量是 g。
(2)计算纯碱样品中碳酸钠的质量分数是多少?(计算结果精确到0 .1%)
.1%)
(3)计算所用稀盐酸的质量分数是多少?
【解析】本题主要结合数据表格考查有关化学方程式的计算。(1)结合数据表格,可知第一次纯碱样品完全反应后生成二氧化碳的质量为5.4 g+100 g+
60 g-163.2 g=2.2 g;(2)(3)由于每5.4 g样品完全反应能产生2.2 g二氧化碳,根据第三次产生6.6 g二氧化碳可以判断第三次样品完全反应,又根据第四次的质量没有 变化,说明第三次的酸也完全反应,因此第三次加入的纯碱样品与100 g盐酸恰好完全反应,共生成二氧化碳6.6 g,根据碳酸钠与盐酸反应的化学方程式,由二氧化碳的质量可以计算碳酸钠的质量及氯化氢的质量,从而可以计算纯碱样品中碳酸钠的质量分数和所用稀盐酸的质量分数
变化,说明第三次的酸也完全反应,因此第三次加入的纯碱样品与100 g盐酸恰好完全反应,共生成二氧化碳6.6 g,根据碳酸钠与盐酸反应的化学方程式,由二氧化碳的质量可以计算碳酸钠的质量及氯化氢的质量,从而可以计算纯碱样品中碳酸钠的质量分数和所用稀盐酸的质量分数 。
。
答案:(1)2.2
(2)(3)第三次加入纯碱样品后与100 g盐酸恰好完全反应,其生成二氧化碳的质量为6.6 g
设前三次加入的纯碱样品中共含有碳酸钠的质量为x。
100 g稀盐酸中含HCl的质量为y
Na2CO3+2HCl====2NaCl+CO2↑+H2O
106 36.5×2 44
x y  6.6 g
6.6 g
106∶44=x∶6.6 g x=15.9 g
73∶44=y∶6.6 g y=10.95 g
纯碱样品中碳酸钠的质量分数为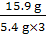 ×100%≈98.1%
×100%≈98.1%
所用稀盐酸的质量分数为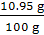 ×100%=10.95%
×100%=10.95%
答:纯碱样品中碳酸钠的质量分数为98.1%,所用稀盐酸的质量分数为10.95%。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:初中化学 来源: 题型:
| 操作步骤 | 现象 | 结论 |
| (1)取该晶体加熟石灰研磨 | 无氨味 | 猜想 3和5 3和5 不成立 |
| (2)另取该晶体加入盐酸 | 有气泡产生 有气泡产生 |
猜想1不成立 |
| (3)另取少量该晶体加水溶解,再滴入氯化钙溶液 | 无白色沉淀 | 猜想4不成立 |
(4)另取该固体放入如图试管中加热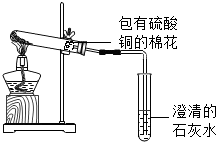 |
包有硫酸铜的棉花变 蓝色 蓝色 色,石灰水变浑浊 浑浊 |
综合(1)、(2)、(3)的结论得出猜想2成立 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com