合成氨是人类科学技术上得一项重大突破,对社会发展与进步做出了巨大贡献.合成氨的工艺流程图如图1:
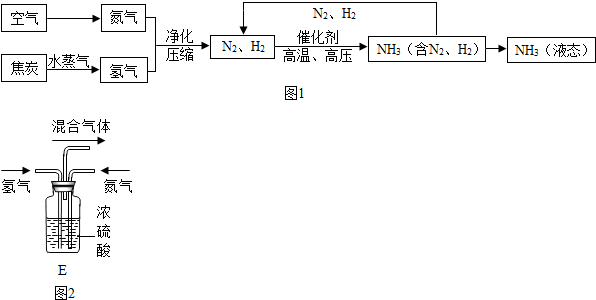
(1)合成氨需要的氮气来自空气,这一变化过程为
化学变化
化学变化
(填“物理变化”或“化学变化”),空气中氮气的体积分数约为
78%
78%
.
(2)制取氢气的反应过程为:C+H
2O
CO+H
2.上述化学方程式中表现氧化性的物质是
H2O
H2O
(填化学式).
(3)写出N
2、H
2反应生成NH
3的化学方程式
.已知同温同压下,相同数目的气体分子具有相同的气体体积,若要让氢气和氮气恰好完全反应,则需要氢气和氮气的体积比为:
3:1
3:1
,若用如图2装置通过调节气体的流速达到控制两种气体的体积比的目的,当你所看到的现象是:
瓶中两导管冒出气泡的速度氢气是氮气的三倍
瓶中两导管冒出气泡的速度氢气是氮气的三倍
时,导出的混合气体恰好完全反应.
(4)将沸点不同的气体分离开来,常采用液化分离法.如,控制温度在-183℃时,可将空气中N
2与O
2分离.根据下表中物质的沸点判断,要将产物NH
3与N
2、H
2分离开来,最适宜的温度应该控制在
-33.35
-33.35
℃.
| 物质 |
H2 |
N2 |
O2 |
NH3 |
| 沸点 |
-252℃ |
-195.8℃ |
-183℃ |
-33.35℃ |

