
【题目】为探究金属的化学性质,兴趣小组使用等质量分数的稀盐酸进行如下实验。
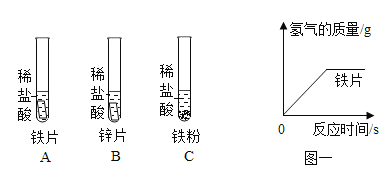
①A中反应的化学方程式是_____,由A、B反应的现象可推出Fe与Zn两种金属的活动性强弱是_____。
②通过比较B、C的反应现象,不能得出铁、锌两种金属的活动性强弱,原因是_____。
③充分反应后,B中固体全部消失,检验溶液中是否含有HCl,不可选择的药品是_____。
A Na2CO3固体
B AgNO3溶液
C CuO
D 铁粉
④A与C中分别放入等质量的铁片与铁粉,在图一中画出铁粉与稀盐酸反应时间与生成氢气的关系的图像_____。
【答案】![]() 锌的活动性比铁强 变量不唯一(片状和粉末接触面积不同,锌和铁金属种类不同,不能比较) B 图像中A是铁粉B是铁片
锌的活动性比铁强 变量不唯一(片状和粉末接触面积不同,锌和铁金属种类不同,不能比较) B 图像中A是铁粉B是铁片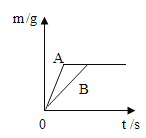
【解析】
①A中铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式是![]() ,由A、B反应的现象是锌片比铁片反应速度快,可推出Fe与Zn两种金属的活动性强弱是:锌的活动性比铁强。
,由A、B反应的现象是锌片比铁片反应速度快,可推出Fe与Zn两种金属的活动性强弱是:锌的活动性比铁强。
②通过比较B、C的反应现象,不能得出铁、锌两种金属的活动性强弱,原因是:变量不唯一(片状和粉末接触面积不同,锌和铁金属种类不同,不能比较金属的活动性)。
③锌和稀盐酸反应生成氯化锌和氢气。
A、Na2CO3固体和稀盐酸反应生成二氧化碳、水、氯化钠,有气泡生成,则有盐酸,没有气泡生成则没有盐酸,可以选择;
B 、AgNO3溶液和氯化锌反应生成氯化银白色沉淀,氯化锌干扰实验,不能选择;
C 、氧化铜和盐酸反应生成氯化铜蓝色溶液,生成蓝色溶液,有盐酸,没有生成蓝色溶液,没有盐酸,可以选择;
D、 铁粉和盐酸反应生成氯化亚铁和氢气,有气泡生成,则有盐酸,没有气泡生成则没有盐酸,可以选择;
故选B。
④A与C中分别放入等质量的铁片与铁粉,生成氢气质量相等,铁粉比铁片接触面积大,反应更快。图像中A是铁粉B是铁片


科目:初中化学 来源: 题型:
【题目】阅读下面科普短文
某北方地区用萝卜叶酱菜制作流程如下:
原料→挑选→切碎→清洗→沥水→腌渍Ⅰ→腌渍Ⅱ→脱盐→酱制→调味→真空包装→杀菌→冷却→成品。
萝卜叶的腌制过程属微生物的发酵过程,蛋白质在微生物蛋白酶和肽酶作用下,会产生一些氨基酸、肽类等风味物质。腌制过程由于微生物的生长代谢消耗了萝卜叶的蛋白质,从而使蛋白质含量下降。酱制、调味后的样品中蛋白质含量增高,其蛋白含量主要来源于酱制和调味过程加入的酱油及味精。酱油中含有蛋白质,味精属谷氨酸钠盐,使成品萝卜叶酱菜中的蛋白质增高。
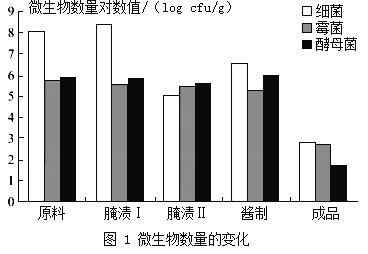
选取原料、腌渍Ⅰ、腌渍Ⅱ、酱制和成品五个工序的样品,进行细菌、霉菌和酵母菌的测定,其实验结果如图1所示。腌渍Ⅰ阶段主要以乳酸菌发酵为主导,乳酸菌正处于对数期,迅速增长;腌渍Ⅱ阶段主要是腌制过程中的盐分产生的高渗透压及发酵所产生乳酸等物质抑制部分微生物的生长。
酱菜中含有乳酸菌,能够调节肠胃功能,有助于儿童、中老年人消化。另外,酱腌中蛋白质、维生素C含量普遍较高,其中含有的乳酸钙还能促进儿童的成长发育。一些蔬菜本来含钙、铁的量较高,经过腌制后得到浓缩,钙、铁含量更为丰富。因此,适量食用酱菜对人体健康有益。
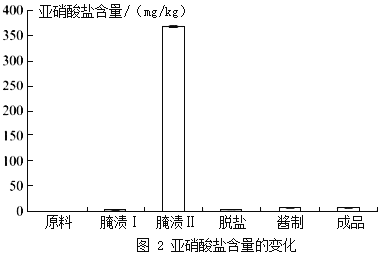
但是,酱菜制作过程中也会产生较高的亚硝酸盐。亚硝酸盐与胃酸反应,产生亚硝酸(HNO2)和氯化物。亚硝酸不稳定,产生的二氧化氮进入血液与血红蛋白结合,导致中毒。酱菜制作过程中亚硝酸盐含量变化如图2所示。
依据文章内容回答下列问题。
(1)钙、铁含量较高的蔬菜,经过腌制成为酱菜,钙、铁含量会更为丰富,这里的“钙、铁”是指_____(填“分子”“原子”“元素”)。
(2)酱制、调味后的酱菜样品中蛋白质含量增高,主要来源是_____。
(3)亚硝酸钠(NaNO2)是常见的亚硝酸盐,亚硝酸钠与胃酸反应的化学方程式为_____。
(4)下列说法正确的是_____。
A 萝卜叶的发酵过程属于物理变化
B 酱菜制作过程中,亚硝酸盐含量在发酵后期达到一个峰值后又迅速下降
C 酱菜制作过程中,霉菌和酵母菌的数量整体呈下降的趋势,细菌数量整体呈上升趋势
D 霉菌和酵母菌在整个腌制、酱制过程中波动较小
(5)有人说儿童不适合吃酱菜,请写一写你的观点,并说明理由:_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】中国科学院科研团队研究成果表明,在常温、常压和可见光条件下,基于LDH(一种固体催化剂)合成氨气(NH3)的原理如图所示。下列说法不正确的是
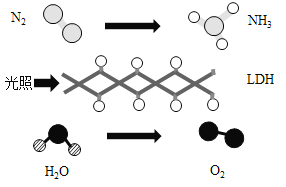
A.四种物质中有一种属于氧化物
B.原料气N2可通过分离液态空气获得
C.参加反应的N2与生成的O2质量比为7:8
D.参加反应的N2与H2O的分子个数比为1:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室常用的实验装置,请回答下列问题。
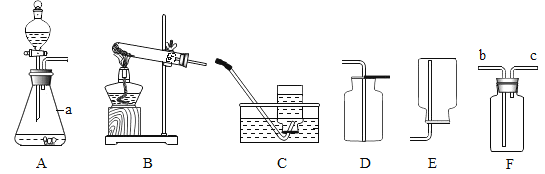
(1)写出仪器a的名称:_________________。
(2)实验室用高锰酸钾制取和收集一瓶较纯净氧气,仪器组合是________________(填装置字母代号),请写出该反应的化学方程式:_____________。
(3)实验室常用大理石与稀盐酸反应制取二氧化碳,若用F进行排空气法收集二氧化碳,检验二氧化碳收集满的方法是______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列四个图象能正确反映对应变化关系的是( )
A.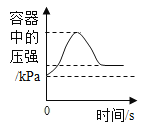 在密闭容器中用红磷测定空气中氧气的含量
在密闭容器中用红磷测定空气中氧气的含量
B.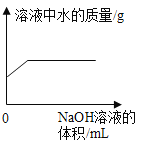 常温下向一定量的稀硫酸中滴加氢氧化钠溶液
常温下向一定量的稀硫酸中滴加氢氧化钠溶液
C.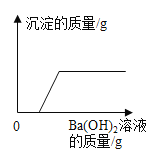 向盐酸和硫酸钠的混合溶液中滴加氢氧化钡溶液
向盐酸和硫酸钠的混合溶液中滴加氢氧化钡溶液
D.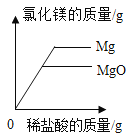 向等质量的镁和氧化镁固体中,分别加入质量分数相同的稀盐酸
向等质量的镁和氧化镁固体中,分别加入质量分数相同的稀盐酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图所示,某河旁甲、乙、丙、丁四座化工厂排放的工业废水中分别含有碳酸钠、氯化铜、氢氧化钠、盐酸中的一种.某同学对①、②、③、④处水质监测时记录了以下现象.根据现象推断,甲、乙、丙、丁四座化工厂排放工业废水的成分,错误的是( )
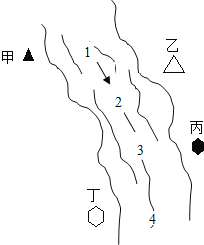
① | ② | ③ | ④ | |
记录现象 | 无色溶液 | 蓝色浑浊 | 浑浊消失 | 产生气泡 |
A.甲:碳酸钠 B.乙:氯化铜 C.丙:盐酸 D.丁:碳酸钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分析数据,获得信息实验室现有硫酸铜和硫酸钠的固体混合物样品,小明同学想测定样品中硫酸铜的质量分数。先称取该混合物样品 25g,完全溶于水中,然后取用了一定溶质质量分数的氢氧化钠溶液 100g 平均分四次加入其中,充分振荡,相关实验数据记录如下:
第1次 | 第2次 | 第3次 | 第4次 | |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 4.9 | 9.8 | X | 14.7 |
请回答下列问题:
(1)上表中 X 的数值为_____________;
(2)计算原固体混合物样品中硫酸铜的质量分数为_____________? (写出计算步骤)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组在实验室里用二氧化锰和浓盐酸在加热条件下制取氯气并进行有关氯气性质的实验探究(如图所示)。
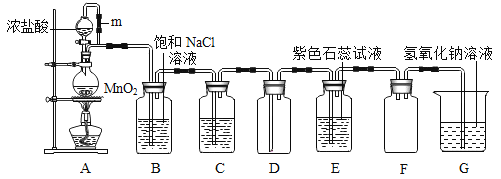
(查阅资料)
Ⅰ、氯气(Cl2)是一种黄绿色的有毒气体,能溶于水,并能与水反应,反应的化学方程式为:![]() ;
;
Ⅱ、氯气溶于水所得的溶液为氯水,氯水除了具有消毒作用,HClO(次氯酸)还具有漂白作用;
Ⅲ、稀盐酸和二氧化锰不发生反应;
Ⅳ、氯气能与氢氧化钠溶液反应。
回答下列问题:
(1)A中m管的作用是_____;
(2)A是制取氯气的发生装置,除生成氯气外还有氯化锰(其中Mn为+2价)和一种常见氧化物,请写出其化学方程式_____;
(3)若进入装置D中的氯气是纯净干燥的,则装置B(饱和氯化钠溶液)的作用是_____,装置C中盛有的溶液是_____;
(4)装置E中石蕊溶液的颜色变化过程为:_____;
(5)①实验装置G的作用是_____;
②通过无数次实验和计算发现,取含溶质146g的浓盐酸和足量的二氧化锰反应,得到的氯气为_____(填字母)。
A 小于71g
B 等于71g
C 大于71g
D 等于35.5g
查看答案和解析>>
科目:初中化学 来源: 题型:
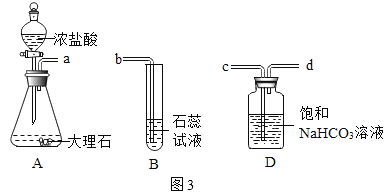
【题目】化学小组用图1装置验证二氧化碳与水的反应。

盐酸浓度 | 观察到的现象 | |
甲组 | 浓盐酸(36.5%) | B中石蕊溶液由紫色变成红色 C中石蕊溶液没有变为紫色 |
乙组 | 稀盐酸(13.5%) | B中石蕊溶液由紫色变为红色 C中石蕊溶液变为紫色 |
(1)A中反应的化学方程式为_____。
(2)乙组C中反应的化学方程式为_____。
(讨论与交流)同学们认为甲组C中石蕊溶液没有变为紫色,是因为浓盐酸挥发出过多的HCl溶于石蕊溶液。
(提出猜想)盐酸的挥发性与浓度有关。
(进行实验)用图2装置研究不同浓度盐酸的挥发性。用离子传感器测定烧杯中所得溶液的氯离子浓度(氯离子浓度可以近似表示挥发出的HCl的量),实验数据见下表。
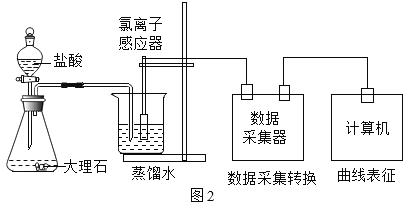
盐酸浓度与氯离子浓度的对应关系(相同时间内测得)
盐酸浓度(%) | 13.5 | 20 | 26.2 | 29.2 | 32.2 | 36.5 |
氯离子浓度(mg/L) | 1.1 | 1.4 | 3.7 | 19.0 | 59.8 | 209.2 |
分析表中数据,能够得出盐酸的挥发性与浓度的关系是_____。
(得出结论)猜想正确
(实验反思)甲组石蕊溶液变红不能证明二氧化碳与水反应。
(实验改进)甲组同学在装置A与装置B之间连接装置D。三个装置之间导管口的连接顺序是:a→_____ →_____→b。选择饱和NaHCO3溶液除杂的原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com