
分析 (1)根据配制溶质质量分数一定的溶液的基本步骤,进行分析解答.
(2)使用托盘天平称量药品时应遵循“左物右码”,称量指定质量的药品,此时先调好砝码和游码,再向左盘增减药品至天平平衡;指针偏右,说明药品质量小于砝码质量,据此进行分析解答.
(3)用量筒量取水时,俯视液面,读数比实际液体体积大,进行分析解答.
(4)根据溶解操作中使用玻璃棒,结合玻璃棒的作用,进行分析解答.
解答 解:(1)用固体氯化钠配制20℃时100g 溶质质量分数为10% 的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、装瓶贴标签.
(2)用托盘天平称量一定量药品,步骤应该是:先调好砝码和游码,再向左盘增减药品至天平平衡,然后向左边托盘添加药品;称量过程中发现指针偏右,说明药品的质量小于砝码的质量,故应进行的操作是继续向左盘添加药品,直至天平平衡.
(3)用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大.
(4)溶解操作中使用玻璃棒,玻璃棒的作用是搅拌,加快溶解速率.
故答案为:(1)计算、称量、溶解、装瓶贴标签;(2)继续向左盘添加药品,直至天平平衡;(3)偏大;(4)搅拌,加快溶解速率.
点评 本题难度不大,明确一定溶质质量分数溶液的配制的步骤(计算、称量、溶解)、注意事项等是正确解答此类题的关键.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:初中化学 来源: 题型:选择题
| A. | NaOH、MgSO4、BaCl2 | B. | HNO3、CuCl2、AgNO3 | ||
| C. | KNO3、NH4Cl、NaOH | D. | KMnO4、Ba(NO3)2、HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯乙烯属于有机物 | |
| B. | 氯乙烯中碳、氢、氯元素的质量比为2:3:1 | |
| C. | 一个氯乙烯分子含有1个氢分子 | |
| D. | 碳元素的质量分数最大 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 打开盛有浓盐酸的试剂瓶的瓶盖,看到瓶口有白烟 | |
| B. | 需量取54mL的蒸馏水 | |
| C. | 若其他操作正确,量取浓盐酸时俯视读数,所得稀盐酸的质量分数大于10% | |
| D. | 把配制好的稀盐酸装入广口瓶中,盖好瓶塞并贴上标签 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
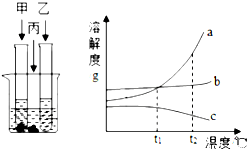 在室温情况下,甲、乙、丙三种固体分别溶于两个试管和烧杯的水中,现象如图所示,甲、丙还有剩余固体,乙固体全部溶解、升温到80℃时,发现甲固体全部溶解,乙有固体析出,丙没有明显变化.
在室温情况下,甲、乙、丙三种固体分别溶于两个试管和烧杯的水中,现象如图所示,甲、丙还有剩余固体,乙固体全部溶解、升温到80℃时,发现甲固体全部溶解,乙有固体析出,丙没有明显变化.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com