
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子很大 | B. | 分子分裂成原子 | ||
| C. | 分子在不停地运动 | D. | 分子之间有空隙 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子很小 | B. | 分子是可分的 | ||
| C. | 分子之间有间隔 | D. | 分子总在不断地运动 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
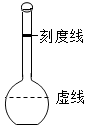 向容积为250ml的细颈玻璃仪器中加水至虚线处,如图.再滴加几滴红墨水,一段时间后,观察到的现象为:整瓶水变红,说明分子在不断的运动,继续向容器中加酒精至凹液面的最低处与刻线相切塞紧玻璃塞将液体摇匀,静置一段时间后,仪器中的现象为:液面低于刻线(且距离较远),说明分子间存在间隔,仪器细颈部分的作用是:便于观察液面变化.
向容积为250ml的细颈玻璃仪器中加水至虚线处,如图.再滴加几滴红墨水,一段时间后,观察到的现象为:整瓶水变红,说明分子在不断的运动,继续向容器中加酒精至凹液面的最低处与刻线相切塞紧玻璃塞将液体摇匀,静置一段时间后,仪器中的现象为:液面低于刻线(且距离较远),说明分子间存在间隔,仪器细颈部分的作用是:便于观察液面变化.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.
镁带在空气中放置一段时间表面会氧化,其中所含的其它杂质与稀硫酸不反应.为了测定某种镁带中镁的质量分数,某实验小组进行如下实验:先用细砂纸打磨镁带表面,使用精密天平称取打磨后11.25克镁带样品放在烧杯中,每次加入40.00克稀硫酸(不考虑水的挥发)使充分反应,测量反应前后装置连同内盛物质的质量.| 加入稀硫酸次数 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯和所称物质总质量(克) | 120.15 | 159.95 | 199.75 | 239.55 | 279.45 | 319.45 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
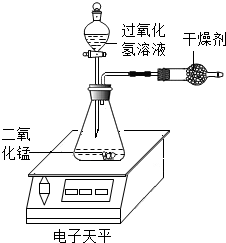 某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| H2O2溶液浓度 | 5% | 5% | 5% | 10% | 10% | 30% | 30% |
| MnO2粉末(g) | 1.0 | 0.8 | 0.6 | 0.6 | 0.4 | 0.4 | 0.2 |
| 所用的时间(s) | 205 | 205 | 220 | 80 | 90 | 3 | 4 |
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 |
| 示数(g) | 565.40 | 565.37 | 565.34 | 565.30 | 565.28 | 565.26 | 565.24 | 565.23 | 565.22 | 565.21 | 565.20 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
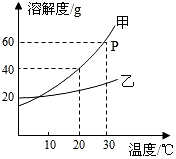 如图是甲、乙两种固体物质的溶解度曲线.据图回答:
如图是甲、乙两种固体物质的溶解度曲线.据图回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com