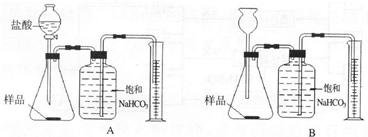
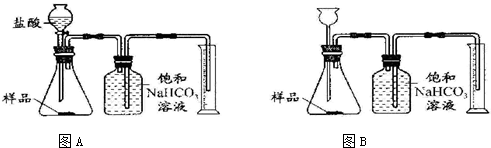
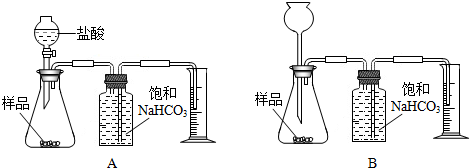
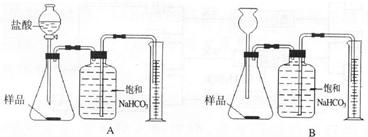
解:(1)分液漏斗能够很方便的控制反应速率,使实验结果更准确,故本题答案为:A
(2)用量筒量取液体时,必须把量筒放平,然后读数,故本题答案为:取出导管,量筒平放,视线与溶液凹液面的最低处保持水平
(3)空气中含有的二氧化碳量很少,所以不会对结果产生大的影响,故本题答案为:没有
(4)浓盐酸具有挥发性,挥发出的氯化氢会与碳酸氢钠反应生成二氧化碳使测量结果偏大,故本题答案为:偏大
(5)取用样品的量产生的二氧化碳的体积不能超过量筒的体积.故答案为:产生气体的体积不能超过量筒体积
(6)根据公式m=ρ v可知二氧化碳的质量=1.96g/L?0.56L=1.09g
设样品中碳酸钠的质量分数为x.
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
106 44
3g?x 1.09g

=
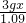
x≈88.3%
答:该样品中碳酸钠的含量是88.3%.
分析:(1)分液漏斗比长颈漏斗更容易控制反应速率,可以据此答题.
(2)注意量筒的读数方法.
(3)二氧化碳在空气中的含量很小.
(4)浓盐酸具有挥发性,挥发出的氯化氢会与碳酸氢钠反应生成气体会影响实验结果.
(5)要根据量筒的最大值确定样品的量.
(6)根据二氧化碳的密度和体积计算出二氧化碳的质量;然后根据碳酸钠和盐酸反应的化学式计算出碳酸钠的量即可.
点评:会用量筒来量取液体,能熟练而准确的读出液体的体积,知道浓盐酸具有挥发性,能够从题给的信息中提取对解题有帮助的信息,并根据题给条件完成解答.本题还考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大

 =
=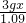


 名校课堂系列答案
名校课堂系列答案