短周期主族元素A、B、C、D、E的原子序数依次增大.已知:A与B能形成一种碱性气体,D是短周期元素中原子半径最大的主族元素,C、E的最外层电子数相等,且C、E的原子序数之和为A、D的原子序数之和的2倍.
试回答下列问题:
(1)写出两种由上述元素形成的具有漂白作用的物质的化学式:
H2O2、Na2O2
H2O2、Na2O2
.
(2)写出由B形成的单质的电子式:
;上述碱性气体是
极性
极性
(填“极性”或“非极性”)分子.
(3)由A、C、E三种元素中的一种或两种可分别形成甲、乙两种粒子,它们均是-2价的阴离子,且甲为四核42电子的微粒,乙为单核18电子的微粒,则甲与乙在酸性条件下反应的离子方程式为:
SO32-+2S2-+6H+═3S↓+3H2O
SO32-+2S2-+6H+═3S↓+3H2O
.
(4)用电子式表示C、D两种元素形成化合物D
2C的过程
.

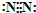
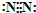
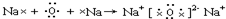
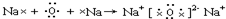
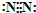 ,极性;
,极性;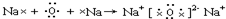 .
.
