解:(1)根据两物质的溶解度曲线可知,在t
1℃时甲的溶解度小于乙的溶解度;
(2)根据溶解度的定义,t
1℃时,将4.2g A物质溶于20.0g水中,刚好形成饱和溶液,则100g水中最多溶解A的质量为21.0g,故t
1℃时,A物质的溶解度为21.0g/100g水或21.0g;
(3)t
2℃时,B物质的溶解度为25g/100g水,在t
2℃时,向50g水中加入15g的B物质,最多溶解12.5g,则充分溶解所得溶液的溶质质量分数为
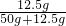
×100%=20%;
(4)由于甲物质的溶解度随温度的升高而明显增大,而乙的溶解度受温度的影响很小,因此可以采取降温结晶(或是冷却热饱和溶液)的方法提纯混有少量乙的甲;
小明用提纯后的A固体和水配制一定质量、一定溶质质量分数的A溶液,配制溶液的步骤是:计算、称量和量取、溶解、装瓶贴标签;小明所配溶液中A溶质质量分数偏小,Ⅰ选项固体仍然不纯,会导致所配溶液中溶质的质量减小,使溶质的质量分数偏小;Ⅱ选项溶解前,烧杯中有少量水,会导致所配溶液溶剂的量增多,溶质的质量分数偏小;Ⅲ选项俯视读数会使量取的水质量减小,使所配溶液溶质的质量分数偏小;Ⅳ选项装瓶时溶液已配好,故洒出不会造成溶液溶质质量分数变化;
故答案为:(1)<;
(2)21.0g/100g水或21.0g;
(3)20%;
(4)降温结晶(或冷却热饱和溶液);溶解;Ⅰ和Ⅱ.
分析:根据固体物质的溶解度曲线可以:①比较不同物质在同一温度下的溶解度大小;②查出某物质在一定温度下的溶解度,从而确定一定量的溶剂中最多溶解的溶质的质量,并确定溶液的溶质质量分数;③判断物质的溶解度随温度变化的变化情况,从而确定通过降温还是蒸发溶剂的方法达到提纯物质的目的,分析溶液配制的步骤,配制溶液溶质质量分数偏小,可能是溶质减少或溶剂增多;溶解度是一定温度下,某固态物质在100g水中达到饱和状态时溶解的质量,并能据此分析确定物质的溶解度.
点评:本题难度不大,主要考查了根据固体物质的溶解度曲线解决相关的问题,以及对溶解度概念的理解及应用,溶液的配制步骤及误差分析,从而培养学生解决问题的能力.

 A、B两种固体物质(均不含结晶水)的溶解度曲线如图所示.
A、B两种固体物质(均不含结晶水)的溶解度曲线如图所示.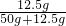 ×100%=20%;
×100%=20%;

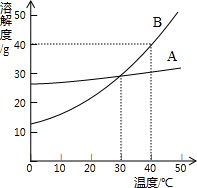 图是A、B两种固体物质的溶解度曲线,据图回答下列问题:
图是A、B两种固体物质的溶解度曲线,据图回答下列问题: (2013?巴中)如图所示是A、B两种固体物质的溶解度曲线,根据曲线回答下列问题:
(2013?巴中)如图所示是A、B两种固体物质的溶解度曲线,根据曲线回答下列问题: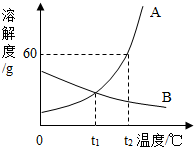 如图是A、B两种固体物质的溶解度曲线.
如图是A、B两种固体物质的溶解度曲线.