
分析 根据氧化镁是白色的解答;
Ⅰ.
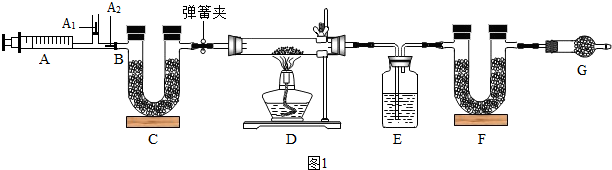
(1)根据装药品前要检验装置的气密性解答;根据浓硫酸具有吸水性解答;
(2)根据二氧化碳和水蒸气会对实验数据产生影响分析;
(3)根据打开弹簧夹,再次反复缓缓推拉注射器,目的是使产生的气体全部进入EF解答;
(4)根据E处浓H2SO4增重(89.4g-87.6g)=1.8g,所以m(H2O)=1.8g,F处碱石灰增重(87.9g-74.7g)=13.2g,所以m(CO2)=13.2g,利用反应的化学方程式解答;
Ⅱ.
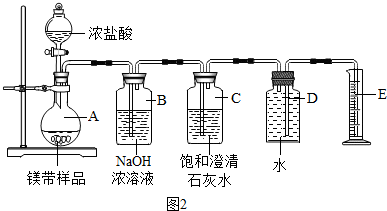
(5)根据装置B中浓氢氧化钠溶液的作用是除去二氧化碳和氯化氢气体进行解答;根据装置C中澄清石灰水的作用是验证二氧化碳是否被除尽进行解答;
(6)根据氢气的体积以及密度求出氢气的质量,利用氢气的质量求出金属镁的质量即可;
(7)根据用这种方法测定的结果一定偏大,原因是滴加的盐酸占一定体积解答;
(8)理论上可以根据生成二氧化碳的量求样品纯度,但是实际上难以通过实验测得纯净的二氧化碳的质量,因为反应前后装置B的质量差中还包括氯化氢和水蒸气的质量;所以难以求解.
解答 解:氧化镁是白色的,灰黑色物质不可能是氧化镁;
Ⅰ.
(1)按图组装好仪器后,检查气密性,E中所装药品是浓硫酸,吸收碱式碳酸镁生成的水;
(2)二氧化碳和水蒸气会对实验数据产生影响,所以G中装置的作用是:吸收空气中的二氧化碳和水蒸气,防止空气中二氧化碳和水进入F;若没有G装置,二氧化碳的质量变大,则测定的x的值会变大;
(3)打开弹簧夹,再次反复缓缓推拉注射器,目的是使产生的气体全部进入EF;
(4)E处浓H2SO4增重(89.4g-87.6g)=1.8g,所以m(H2O)=1.8g,F处碱石灰增重(87.9g-74.7g)=13.2g,所以m(CO2)=13.2g,
Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O
58 18
x 1.8g
$\frac{58}{x}=\frac{18}{1.8g}$
x=5.8g
Mg(OH)2 的个数为:$\frac{5.8}{58}$=0.1
MgCO3 $\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO2 ↑
84 44
x 13.2g
$\frac{84}{x}=\frac{44}{13.2g}$
x=25.2g
MgCO3 的个数为:$\frac{25.2}{84}$=0.3
该碱式碳酸镁的化学式为3MgCO3.Mg(OH)2
Ⅱ.
(5)装置B中浓氢氧化钠溶液的作用是除去二氧化碳和氯化氢气体;装置C中澄清石灰水的作用是验证二氧化碳是否被除尽;
(6)氢气的质量=0.448L×0.089g/L≈0.04g
设生成0.04g氢气至少需要金属镁的质量为x
Mg+H2SO4═MgSO4+H2↑
24 2
x 0.04g
$\frac{24}{x}=\frac{2}{0.04g}$
x=0.48g
镁带样品纯度=$\frac{0.48g}{1g}×$100%=48%;
所以则称取的样品质量应大于0.48g;
(5)测得二氧化碳的体积偏大,原因可能有:浓盐酸易挥发,产生的氯化氢气体被装置B吸收;二氧化碳气体逸出时带出的水蒸气在装置B中冷凝而被吸收;装置A、B内空气中的二氧化碳被装置B吸收.
答案:
MgO为白色;
Ⅰ.确定镁带表面碱式碳酸镁的成分
(1)检查气密性; 浓硫酸;
(2)防止空气中二氧化碳和水进入F;变大;
(3)使产生的气体全部进入EF;
(4)3MgCO3.Mg(OH)2
Ⅱ.测定镁带样品纯度
(5)除CO2和HCl; 检验二氧化碳是否除尽;
(6)48%;
(7)滴加的盐酸占一定体积;
(8)①②③.
点评 本题主要考查了学生对洗气瓶的接口问题、CO2 与氢氧化钠、氢氧化钙反应的现象、用途的知识,同时锻炼了学生的审题能力和综合分析能力.


科目:初中化学 来源: 题型:多选题
| A. | 2Fe+6HCl═2FeCl2+3H2↑ | B. | Cu+H2SO4═CuS04+H2↑ | ||
| C. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe203 | D. | 2NaOH+SO2═Na2SO3+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用灼烧法鉴别棉花和羊毛 | |
| B. | 用蒸馏水鉴别氢氧化钠固体和硝酸铵固体 | |
| C. | 用带火星的木条鉴别空气和氧气 | |
| D. | 用品尝的方法鉴别稀盐酸和氯化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| 编号 | 物质 | 杂质 | 除杂操作方法 |
| A | CO2 | CO | 点燃 |
| B | NaOH | NaCl | 加足量盐酸 |
| C | 氯化钠 | 泥沙 | 加足量的水,溶解、蒸发、结晶 |
| D | O2 | 水蒸气 | 用浓硫酸洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
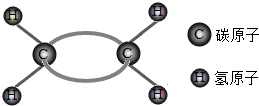 乙烯是合成聚乙烯的重要原料,其分子结构如图,下列叙述错误的是( )
乙烯是合成聚乙烯的重要原料,其分子结构如图,下列叙述错误的是( )| A. | 乙烯分子中含有6个原子核 | |
| B. | 乙烯中碳、氢元素的质量比为6:1 | |
| C. | 乙烯是一种有机化合物 | |
| D. | 乙烯分子中质子数和电子数之比为1:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com