
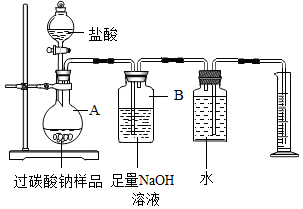
 “氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na2CO3•3H2O2).某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究.
“氧泡泡”系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na2CO3•3H2O2).某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究.分析 (1)根据酸碱度与酸碱性的关系分析回答;
(2)根据过氧化氢在二氧化锰的作用下分解生成了氧气写出反应的化学方程式;
(3)①根据过碳酸钠与盐酸反应生成了气体分析回答;
②根据二氧化碳能与氢氧化钠反应写出反应的化学方程式;.
③根据氧气的体积和密度可以求出氧气的质量分析回答.
④根据过碳酸钠与盐酸反应生成的氯化钠的质量可求出氧气的质量,据此可求出过碳酸钠样品的“活性氧”含量.
⑤根据盐酸易挥发出氯化氢气体分析回答.
解答 解:(1)20℃时,测得1%过碳酸钠水溶液的pH为10.5,大于7,说明其溶液呈碱性.
(2)由于过氧化氢在二氧化锰的作用下分解生成了氧气,所以向过碳酸钠水溶液中加入少量MnO2时产生大量气泡,该气体是氧气,发生反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)①由于过碳酸钠与盐酸反应生成了二氧化碳和氧气,所以将盐酸慢慢地入A中,反应一段时间,观察到没有气泡生成,停止滴加盐酸.
②由于氢氧化钠能与二氧化碳反应,所以装置B可吸收生成的CO2,该反应的化学方程式是:CO2+2NaOH═Na2CO3+H2O.
③由题意可知,由量筒可读出氧气的体积,若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的密度.
④设生成的氧气的质量为x,
2(2Na2CO3•3H2O2)+8HCl═8NaCl+4CO2↑+3O2↑+10H2O
468 96
11.7g x
$\frac{468}{96}=\frac{11.7g}{x}$ 解得:x=2.4g
过碳酸钠样品的“活性氧”含量是:$\frac{2.4g}{20g}×100%$=12%;
⑤由于盐酸易挥发出氯化氢气体,完成上述探究后,丙同学提出:称量反应前后装置B的质量,其质量差就是反应生成CO2的质量,据此可计算出样品中“活性氧”含量.该方案不合理,理由是盐酸挥发出的氯化氢气体进入到B中.
故答为:(1)碱性;(2)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.(3)①没有气泡生成.②CO2+2NaOH═Na2CO3+H2O.③密度.④12%;⑤不合理,盐酸挥发出的氯化氢气体进入到B中.
点评 本题通过“氧泡泡”考查了氧气的制取二氧化碳的性质,综合性很强,但难度不大,利用已有的知识分析解答即可.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 一定温度下将某硝酸钾溶液分成两等份,一份等温蒸发10克水,得到m克无水晶体;另一份等温蒸发12.5克水,得到3m克无水晶体,则该温度下硝酸钾的溶解度为( )
一定温度下将某硝酸钾溶液分成两等份,一份等温蒸发10克水,得到m克无水晶体;另一份等温蒸发12.5克水,得到3m克无水晶体,则该温度下硝酸钾的溶解度为( )| A. | 10m克 | B. | 24m克 | C. | 80m克 | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| ①用试管取少量小烧杯中反应后的溶液,滴加几滴酚酞试液(填酸碱指示剂) | 溶液变红色 | 该溶液显碱性 |
| ②将小烧杯中反应后剩下的溶液进行称量,然后滴加过量的BaCl2溶液 | 有 白色沉淀生成 | 猜想(4)不成立 |
| ③取步骤②中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(2)不成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2% | B. | 9.3% | C. | 0.93% | D. | 0.093% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com