
科目:初中化学 来源: 题型:填空题
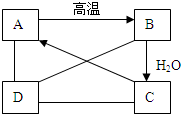 有A、B、C、D四种物质,如图所示,A、B、C、D在一定条件下可以转化,在C溶液中通入二氧化碳气体,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有二氧化碳气体产生,D与硝酸银溶液反应可产生不溶于稀硝酸的白色沉淀.
有A、B、C、D四种物质,如图所示,A、B、C、D在一定条件下可以转化,在C溶液中通入二氧化碳气体,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有二氧化碳气体产生,D与硝酸银溶液反应可产生不溶于稀硝酸的白色沉淀.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
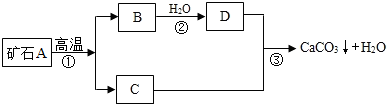
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
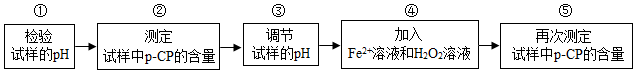
| 实验编号 | 温度/℃ | pH | 测得p-CP的含量随时间变化的关系图 |
| a | 25 | 10 | 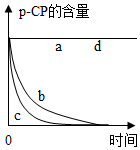 |
| b | 25 | 3 | |
| c | 40 | 3 | |
| d | 40 | 10 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 蜡烛的燃烧
蜡烛的燃烧查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com