
【题目】盐十金属→_____(_____反应)
 _____;_____
_____;_____
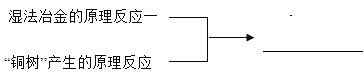 _____
_____
活动性顺序表中氢以后金属间发生置换反应:_____。
【答案】新的金属+新的盐 置换 大于 能溶于水 Fe+ CuSO4 = FeSO4 + Cu Cu+2AgNO3=Cu(NO3)2+2Ag
【解析】
盐十金属→新的金属+新的盐,属于由一种单质和一种化合物生成另一种单质和另一种化合物的置换反应;
金属和盐的反应条件:单质中的金属,其活动性比盐中金属的活动性强,参加反应的盐必须能溶于水;湿法炼铜就是利用比铜活泼的金属和含有铜的可溶盐反应得到金属铜,通常是指铁和硫酸铜反应生成硫酸亚铁和铜,生成的铜附着在铁的表面(铜树),反应方程式为Fe+ CuSO4 = FeSO4 + Cu;
活动性顺序表中氢以后金属间发生置换反应:如铜和硝酸银反应生成硝酸铜和银,反应方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】为探究锌、铜、铁三种金属的活动性顺序,某学习小组做了如甲图所示实验。实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多(如乙图所示)。

下列说法正确的是
A.反应后烧杯中的固体一定含有铁
B.甲图试管②中反应后固体一定不含铁
C.反应后烧杯中的溶液一定不含有氯化铜
D.烧杯中最后所得固体的质量一定大于2a克
查看答案和解析>>
科目:初中化学 来源: 题型:
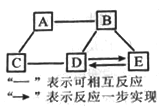
【题目】A~E均为初中化学常见的物质,它们之间的关系如图所示(部分物质已经略去)。已知A是目前世界上年产量最高的金属;B是胃酸的主要成分;C中金属元素的质量分数为40%, 其水溶液呈蓝色,常用来配制农药波尔多液;D属于碱;E属于盐。则C的化学式为__________;A与B反应的化学方程式为__________;E转化为D的化学方程式为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以化合价为纵坐标,物质类别为横坐标所绘制的图象叫价类图,如图为碳的价类图,例如C点可能标示+2价的碳的氧化物,请回答:
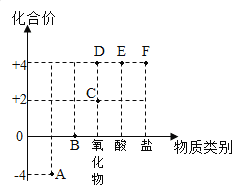
(1)A点所表示的物质是天然气的主要成分,其化学式为_____。
(2)B点对应的物质类别是_____。
(3)D和水反应能生成E,化学方程式为_____,该反应属于基本反应类型中的_____。
(4)若F点表示的物质为含有4种元素的钠盐,该盐的用途有_____(任写一种)。
(5)查资料可知:元素处于最高价,只有氧化性:元素处于最低价,只有还原性,则CO可能具有的性质是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某天然矿泉水的主要矿物质成分如下,请认真阅读后回答下列问题:
矿泉水天然的主要成分(mg/L):碳酸氢根(HCO3![]() ):173~205;氯离子(Cl
):173~205;氯离子(Cl ![]() ):1.0~8.0 ;硫酸根(SO42
):1.0~8.0 ;硫酸根(SO42![]() ):16.08~19.52;钠离子(Na+):8~50;镁离子(Mg2+):2.5~12.5
):16.08~19.52;钠离子(Na+):8~50;镁离子(Mg2+):2.5~12.5
pH值:7.8±0.5
(1)矿物质成分的硫酸根“SO42-”中数字“2”的含义是_______________。
(2)该种矿泉水显______性(填“酸”、“碱”或“中”)水。
(3)若用自来水假冒矿泉水或纯净水出售。请你设计探究实验进行识别(简述操作步骤、现象和结论)_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两组同学为探究氢氧化钙的化学性质,分别做了如下相同的四个实验:
请回答下列问题:
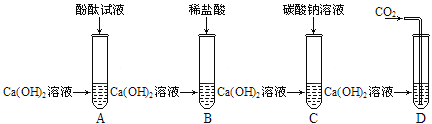
(1)试管D中的现象是____。
(2)以上实验中,能发生反应但无明显现象的化学方程式____。
(继续探究)
实验结束后,甲、乙两组同学分别将本组A、B、C、D四支试管中的物质各倒入一个洁净的大烧杯中,充分反应后静置,发现:
①甲组烧杯底部有白色沉淀,上层清液为无色。则上层清液中一定含有的溶质是_____(指示剂除外),可能含有的溶质是_____。
②乙组烧杯底部有白色沉淀,上层清液为红色,则上层清液中一定没有的离子是____。
(拓展延伸)
甲、乙两组同学共同讨论后一致认为两个烧杯底部的白色沉淀为同一物质,请写出本实验过程中产生该白色沉淀的化学方程式____(写一个即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表中,有关量的变化图象与其对应叙述相符的是( )
A. 一定量的饱和石灰水中加入氧化钙
一定量的饱和石灰水中加入氧化钙
B.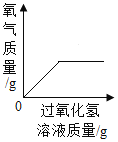 向一定质量的二氧化锰中加入过氧化氢溶液
向一定质量的二氧化锰中加入过氧化氢溶液
C. 向一定质量 AgNO3 和 Cu(NO3)2 的混合溶液中加入 Zn 粉
向一定质量 AgNO3 和 Cu(NO3)2 的混合溶液中加入 Zn 粉
D. 常温下,相同质量的锌和铁与等质量的溶质质量分数相同的稀硫酸反应
常温下,相同质量的锌和铁与等质量的溶质质量分数相同的稀硫酸反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】果果在观看央视“315”晚会,了解到二甲醚不可违规充装到民用液化气罐里,不然会留下一些安全隐患。她对二甲醚进行如下探究:
(查阅资料)
①二甲醚(DME)在常温常压下是一种无色气体或压缩液体,具有轻微醚香味,溶于水和乙醇中,接触空气或在光照条件下可生成具有潜在爆炸的危险物质。
②二甲醚(CH3OCH3)具有清洁无污染、易于制造的特性,将有望成为液化石油气(LPG)和石油类的替代燃料,将成为21世纪的新能源之一。
(结论与解释)
(1)二甲醚可由合成气(CO和H2)在一定的条件下制备,同时产生一种可参与大气循环的、常温为液态的化合物,写出该反应的化学方程式为_____________。
(2)甲醚被誉为“21世纪的清洁燃料”,二甲醚在空气中充分燃烧生成二氧化碳和水,该反应的化学方程式是________________。
(应用拓展)
(3)高纯度的二甲醚可替代氟里昂用作冰箱和空调的致冷剂,可减少对臭氧层的破坏。臭氧每个分子中含有三个氧原子,则臭氧的化学式为___,属于____(填“单质”、“化合物”或“混合物”)。
(4)由液化石油气掺入二甲醚将有安全隐患,到二甲醚可用作城市客车的清洁燃料。你对物质的性质与用途之间的关系有什么认识? _________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科技部在“十二五规划”期间出台稀有金属研发产业扶持政策。如图是稀土元素钇在元素周期表中的相关信息,下列说法中有错误的是( )

A.钇元素的原子序数为39B.钇元素属于金属元素
C.钇元素的元素符号为YD.钇元素的相对原子质量为88.91g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com