


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
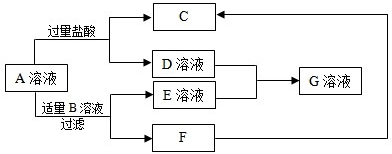
科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:
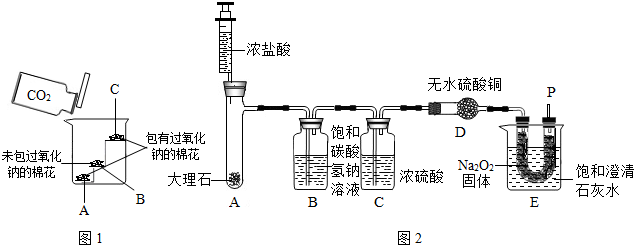
 (2012?丰台区二模)工业纯碱中常含有少量的NaCl杂质.右图是测定纯碱样品中Na2CO3质量分数的实验装置(气密性良好,样品质量为11.0g,装置D的质量为172.2g).操作步骤为:将样品装入广口瓶中→打开止水夹,缓缓鼓入空气数分钟→连接装置D→关闭止水夹,向盛有样品的广口瓶中滴加稀硫酸至不再产生气泡→打开止水夹,再缓缓鼓入空气数分钟→称量装置D的质量为176.6g.(假设每套装置均反应完全).
(2012?丰台区二模)工业纯碱中常含有少量的NaCl杂质.右图是测定纯碱样品中Na2CO3质量分数的实验装置(气密性良好,样品质量为11.0g,装置D的质量为172.2g).操作步骤为:将样品装入广口瓶中→打开止水夹,缓缓鼓入空气数分钟→连接装置D→关闭止水夹,向盛有样品的广口瓶中滴加稀硫酸至不再产生气泡→打开止水夹,再缓缓鼓入空气数分钟→称量装置D的质量为176.6g.(假设每套装置均反应完全).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com