
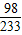 =
= ,x=4.9g
,x=4.9g

 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:阅读理解
| ||
| 100 |
| x |
| 56 |
| 6.04g |
| 10.78 |
| 10 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论 |
将A、B两溶液各取少量,分别放入两支试管中, 将A、B两溶液各取少量,分别放入两支试管中, 分别滴入少量的饱和碳酸钠溶液 分别滴入少量的饱和碳酸钠溶液 |
A样品中 气泡冒出 气泡冒出 B样品中 产生沉淀 产生沉淀 |
A是 稀硫酸 稀硫酸 B是 饱和氢氧化钙溶液 饱和氢氧化钙溶液 产生白色沉淀的化学方程式是 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH Na2CO3+Ca(OH)2═CaCO3↓+2NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 CaO+CO2↑
CaO+CO2↑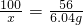 x=lO.78g
x=lO.78g 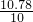 ×100%=107.8%
×100%=107.8%查看答案和解析>>
科目:初中化学 来源:防城港 题型:问答题
| ||
| 100 |
| x |
| 56 |
| 6.04g |
| 10.78 |
| 10 |
查看答案和解析>>
科目:初中化学 来源:2005年广西玉林市中考化学试卷(解析版) 题型:解答题
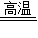 CaO+CO2↑
CaO+CO2↑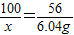 x=lO.78g
x=lO.78g 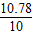 ×100%=107.8%
×100%=107.8%查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com