
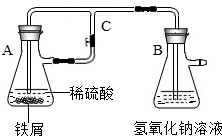
 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3.这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+. |
| ||


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:初中化学 来源: 题型:

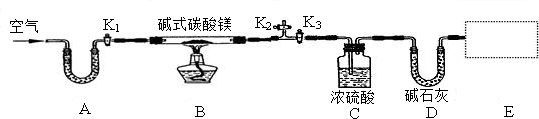
| 编号 | KClO3质量(g) | 其他物质质量(g) | 待测数据 |
| 1 | 2.0 | 不加任何物质 | … |
| 2 | 2.0 | CuO 0.5 | … |
| 3 | 2.0 | MnO2 0.5 | … |
| 实验步骤 | 实验过程及现象 | 设计目的 |
| 1 | 加入CuO后产生O2的速率比未加入时快得多 | CuO能加快KClO3的分解 |
| 2 | CuO的质量在反应前后是否保持不变 | |
| 3 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 反应前 | 反应后 |
| C装置及药品总质量:87,6g | C装置及药品总质量:89,4g |
| D装置及药品总质量:74,7g | D装置及药品总质量:83,5g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 物质 | Ca(HCO3)2 | Mg(HCO3)2 | Mg(OH)2 | Ca(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 不溶 | 微溶 | 不溶 | 微溶 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实 验 内 容 | 实 验 现 象 |
| 方案Ⅰ 把维生素C片研碎,溶解在水中,滴入适量的石蕊试液 把维生素C片研碎,溶解在水中,滴入适量的石蕊试液 |
石蕊试液变红色 石蕊试液变红色 |
| 方案Ⅱ 把酚酞试液滴入氢氧化钠溶液中,再把研碎的维生素C片放入氢氧化钠溶液中 把酚酞试液滴入氢氧化钠溶液中,再把研碎的维生素C片放入氢氧化钠溶液中 |
酚酞试液先变红色,后又变成无色 酚酞试液先变红色,后又变成无色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | Ca(HCO3)2 | Mg(HCO3)2 | Mg(OH)2 | Ca(OH)2 | CaCO3 | MgCO3 |
| 溶解性 | 可溶 | 可溶 | 不溶 | 微溶 | 不溶 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com