
【题目】科技推动着奥林匹克运动的发展,在奥运会中化学的表现十分突出。

(1)“鸟巢”的建造中使用了大量的钢铁。生产这些钢铁时要在高温条件下将Fe2O3用一氧化碳还原成铁,其反应的化学方程式为_____。
(2)“水立方”的膜结构是由化学合成材料ETFT制成的,化学式是(C2H2F2)n ,则其相对分子质量的计算式是_____。
(3)撑杆跳高使用的玻璃纤维杆,其主要成分是SiO2、Al2O3等,在物质分类中它们属于__(填序号)。
A.单质 B.化合物 C.氧化物
(4)采集奥林匹克圣火的唯一方式,是在奥林匹克的赫拉神庙前通过太阳光集中在凹面镜的中央,引燃圣火。此过程中最关键的燃烧条件是______________。
(5)奥运会需要大量的能量。物质发生化学反应的同时,伴随着能量的变化,通常表现为____的变化。太阳能、___、___潮汐能等新能源的广泛开发利用还有待于研究。
【答案】Fe2O3+3CO![]() 2Fe+3CO2 (12×2 + 1×2 +19×2) ×n B C 温度达到可燃物的着火点 热量 核能或风能或地热能等
2Fe+3CO2 (12×2 + 1×2 +19×2) ×n B C 温度达到可燃物的着火点 热量 核能或风能或地热能等
【解析】
(1)由题意可知反应物、反应条件、生成物,故写出CO与Fe2O3在高温条件下反应的化学方程式:Fe2O3+3CO![]() 2Fe+3CO2;(2)化学式是(C2H2F2)n的ETFT相对分子质量的计算式是:(12×2+1×2+19×2)×n;(3)二氧化硅、氧化铝都是由氧元素和另外一种元素组成的化合物,属于氧化物;(4)燃料与空气中的氧气充分接触,引燃圣火的关键是凹面镜聚集的热量能否达到燃料的着火点;(5)物质发生化学反应的同时,伴随着能量的变化,通常表现为热量的变化。人类通过化学反应获得的能量大多来自于化石燃料,但还要努力开发太阳能、核能(或风能或地热能等)、潮汐能等新能源。
2Fe+3CO2;(2)化学式是(C2H2F2)n的ETFT相对分子质量的计算式是:(12×2+1×2+19×2)×n;(3)二氧化硅、氧化铝都是由氧元素和另外一种元素组成的化合物,属于氧化物;(4)燃料与空气中的氧气充分接触,引燃圣火的关键是凹面镜聚集的热量能否达到燃料的着火点;(5)物质发生化学反应的同时,伴随着能量的变化,通常表现为热量的变化。人类通过化学反应获得的能量大多来自于化石燃料,但还要努力开发太阳能、核能(或风能或地热能等)、潮汐能等新能源。


科目:初中化学 来源: 题型:
【题目】在汽车尾气净化装置中装有催化剂,下图为尾气在催化剂表面反应的微观过程,请回答:
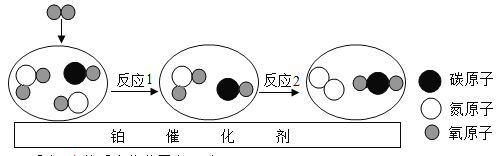
(1)汽车尾气的主要成分是________________(填化学式)。
(2)反应I中,有______种分子发生了变化,在该反应中属于单质的物质是_________(填化学式)
(3)反应Ⅱ中若有14g一氧化碳发生反应,其中的碳元素完全转化为二氧化碳中的碳元素,则生成二氧化碳的质量为____________g。
(4)由图中可知化学反应前后:种类不发生改变的微粒是____________(填“分子”或“原子”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。课外小组为了测定该石灰石样品中碳酸钙的质量分数,将一定量的石灰石样品放入烧杯中,再将100 g稀盐酸分4次加入烧杯中,每次均充分反应。实验数据记录如下:
次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
反应后烧杯中物质的总质量/g | 35.2 | 58.4 | 82.6 | 107.6 |
(1)第1次加入稀盐酸充分反应后,生成二氧化碳的质量。
(2)该石灰石样品中碳酸钙的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了几种气体的制备实验。

(1)写出仪器a的名称:___________。
(2)甲同学选择装置BE制氧气。选用E装置收集氧气的原因是________,若改用F装置收集氧气,氧气从导管_______(填“b”或“c”)进入。用分液漏斗相比较长颈漏斗的优点是________,实验结束后,若将MnO2分离开来的操作是__________,用B装置还用于实验室制取CO2,该反应的化学方程式是_________。
(3)乙同学实验发现,只用KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。KClO3的分解速率大大加快的原因是________。
实验反思:通过以上实验探究,你对催化剂的认识是______。
A.MnO2只能作过氧化氢溶液分解的催化剂
B.催化剂在反应前后质量和性质都不变
C.催化剂能加快化学反应的速率,不影响生成物的量
D.用作催化剂的物质可能是其他反应的反应物或生成物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明设计了如下图所示的实验装置,进行CO还原CuO的实验.试回答:
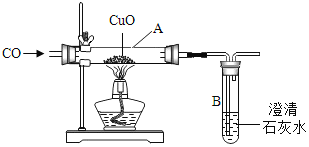
﹙1)该装置存在一处不完善的地方是 ______ ;解决的方法是 ______ 。
(2)实验开始时,先要进行的操作是 ______ ;为什么 ______ 。(选填序号:①加热②通CO)
(3)实验过程中A和B处的实验现象分别是 _________ , _________ ,A处的化学反应化学方程式______ ; B处反应的化学方程式是 ______ 。
(4)实验结束后,先熄灭酒精灯,再停止通一氧化碳,其原因是____________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:

(1)写出实验中发生的化学反应的化学式表达式:_____________,二氧化锰在反应中的作用是__________。取用二氧化锰可以用________(填“药匙”或“镊子”)。
(2)MnO2中锰元素的化合价为___________;
(3)实验2中应加入5%H2O2_____________毫升;
(4)在两次实验中,可通过_______________来比较H2O2分解反应速率的大小;
(5)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有______________;
(6)实验结束后若要将MnO2从混合物中分离回收,可采取的方法是_____________。该方法用到的玻璃仪器有玻璃棒、___________、____________。玻璃棒的作用是______,将本实验中的二氧化锰经分离、干燥后称量,其质量为________g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学用语是我们学习化学的重要工具,请用适当的化学用语填空:
(1)钙元素_________;(2)五氧化二磷____________;(3)2个氢离子__________;
(4)氖气______;(5)硫酸根离子___;(6)标出N2O5中氮元素的化合价___;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象能正确反映其对应关系的是( )
A. 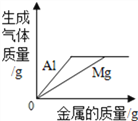 向盛有相同的稀硫酸溶液的两支试管中,分别加入过量的镁和铝
向盛有相同的稀硫酸溶液的两支试管中,分别加入过量的镁和铝
B. 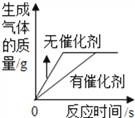 在两份相同的过氧化氢溶液中,一份加催化剂,一份不加催化剂
在两份相同的过氧化氢溶液中,一份加催化剂,一份不加催化剂
C. 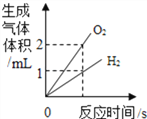 通电使水分解
通电使水分解
D.  向一定量硫酸亚铁溶液中加入一定量金属锌
向一定量硫酸亚铁溶液中加入一定量金属锌
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质的溶解度曲线如图所示.根据下图中信息回答下列问题:
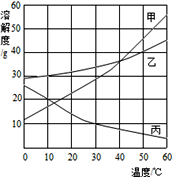
(1)50℃时,乙物质的溶解度是_______g。
(2)40℃时,甲、乙、丙三种物质的饱和溶液各1195克,则在甲、乙、丙三种物质饱和溶液中含有水的质量大小顺序为_____________。(用甲、乙、丙表示)
(3)甲、乙、丙三种饱和溶液,温度由50℃逐渐降低到20℃时,____________溶质的质量分数没有改变。(用甲、乙、丙表示)
(4)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时升温至60℃,所得溶液中溶质质量分数最小的是_____。
(5)要配制140g溶质质量分数为28.5%的乙物质溶液,配制时溶液的温度需要控制的范围是_______。(填“≥50℃”或“≥40℃”或“≥30℃”或“≥20℃”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com