
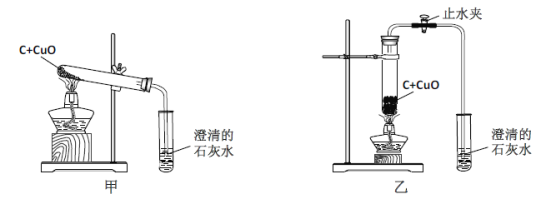
【题目】某化学兴趣小组按照课本实验方法(如下图),做木炭与氧化铜反应的实验时,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现。他们决定对这个实验进行探究和改进。
【提出问题】暗红色的固体是什么?如何选择合适条件,使木炭还原氧化铜的实验现象更明显?
【查阅资料】铜有+1 和+2 两种化合价,通常情况下,氧的化合价为-2,碳的化合价为+4 或-4。
【猜想与假设】
(1)同学们认为这种暗红色固体可能是一种化合物,并猜测它的化学式为 。
(2)同学们还认为,通过改变反应物的状态、质量比,以及反应装置,可以使该实验现象
更加明显,减少出现暗红色固体的情况。
【分析与交流】
(1)小吴建议用超细炭粉与氧化铜粉末进行实验。你认为这样建议的原理是 ;反应的化学方程式为 。
(2)小周建议用图乙装置替代甲装置。与甲相比较,乙装置中将试管直立放置的好处是 。
【实验与结论】
同学们决定按改进后的方案进行实验,他们在检验了乙 后,往试管中加入已干燥的药品并开始加热,当看到澄清的石灰水刚出现浑浊时, (填“可以”或“不能”)确定氧化铜和炭粉已经开始反应。不久,即可看到试管底部变红热,停止加热后,仍能看到红热现象,并沿试管底部自下而上蔓延,这个现象说明该反应是 (填“吸”或“放”)热反应。待产物冷却后,同学们终于找到了期待已久的紫红色铜珠,实验获得了圆满成功。
【答案】【猜想与假设】![]() (
(![]() )
)
【分析与交流】(1)这是固体反应物间的反应,使用颗粒更小的反应物,可以增加表面积,有利于反应的进行;C+2CuO ![]() 2Cu+CO2↑(2)有利于集中加热,获得持续高温。
2Cu+CO2↑(2)有利于集中加热,获得持续高温。
【实验与结论】装置的气密性; 不能; 放
【解析】
试题分析:根据质量守恒定律可以推测该物质可能是氧化亚铜,或者是碳元素和铜元素形成的化合物,小吴建议用超细炭粉与氧化铜粉末进行实验。这样建议的原理是这是固体反应物间的反应,使用颗粒更小的反应物,可以增加表面积,有利于反应的进行;反应的化学方程式为C+2CuO ![]() 2Cu+CO2↑。小周建议用图乙装置替代甲装置。与甲相比较,乙装置中将试管直立放置的好处是有利于集中加热,获得持续高温;检验了乙装置的气密性后,往试管中加入已干燥的药品并开始加热,当看到澄清的石灰水刚出现浑浊时,不能确定氧化铜和炭粉已经开始反应。不久,即可看到试管底部变红热,停止加热后,仍能看到红热现象,并沿试管底部自下而上蔓延,这个现象说明该反应是放热反应,因为停止加热后仍是红热的。
2Cu+CO2↑。小周建议用图乙装置替代甲装置。与甲相比较,乙装置中将试管直立放置的好处是有利于集中加热,获得持续高温;检验了乙装置的气密性后,往试管中加入已干燥的药品并开始加热,当看到澄清的石灰水刚出现浑浊时,不能确定氧化铜和炭粉已经开始反应。不久,即可看到试管底部变红热,停止加热后,仍能看到红热现象,并沿试管底部自下而上蔓延,这个现象说明该反应是放热反应,因为停止加热后仍是红热的。


科目:初中化学 来源: 题型:
【题目】某同学用pH试纸测定日常生活中的一些液体的pH.他的实验记录一定错误的是( )
A.肥皂水pH=10 B.纯碱溶液pH=11 C.橘子汁pH=4 D.食醋pH=7
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)“84”消毒液可用于灾区防疫,其主要成分是次氯酸钠(NaClO),制取它的化学方程式为2NaOH+X═NaClO+NaCl+H2O,则X的化学式为 .求出NaClO中氯元素化合价并在该化学式中表示出来.
(2)固体MgH2是氢能源汽车的供能剂,MgH2可以和水反应生成氢氧化镁,同时释放出氢气,该反应的化学方程式是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究燃烧的条件,某同学查阅资料得知:白磷为白色蜡状固体,剧毒,不溶于水,着火点为40oC;红磷的着火点为240oC。然后按下图所示A装置进行实验。
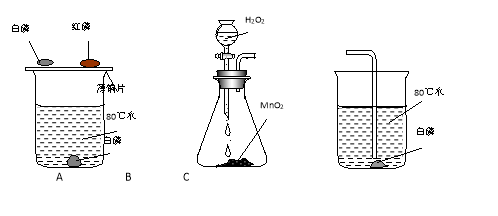
(1)观察到的现象为:铜片上的白磷和红磷分别是 ②水下的白磷 ;
(2)在使用组装好的B装置前,首先应该进行的操作是 ,然后加入药品并将B和C装置连接,滴入双氧水,B装置中反应的化学方程式为 ,C装置中的白磷燃烧。
(3)从以上实验分析可得出燃烧的条件为:可燃物、 和 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明不慎被蜜蜂蛰伤。蜜蜂的刺液是酸性的,下列物品中可以用来涂抹在蛰伤处,减轻疼痛的是( )
A、苹果汁(pH约为3) B、牛奶(pH约为6.5)
C、矿泉水(pH约为7) D、肥皂水(pH约为10)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列对分子、原子和离子的认识正确的是 ( )
A、都是带电荷的粒子
B、都是构成物质的基本粒子
C、都是化学变化中的最小粒子
D、分子是运动的而原子、离子是静止的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某白色固体可能是煅烧碳酸钙后的剩余物,为确定其成分,进行如下实验:

① 高温煅烧碳酸钙的化学方程式是 ;
② 分离B中难溶物的操作Ⅰ是 ;
③ 操作Ⅱ的目的是 ,D中白色固体可能是 ;
④ 为达到实验目的,还应进行的操作是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】研究小组进行木炭还原氧化铁的探究活动。将木炭、氧化铁及试管充分烘干,并将木炭和氧化铁混合均匀、研磨。取适量上述混合物于试管中,用图1所示的装置加热(试管竖直向上,可使加热时的热量尽少散失)。
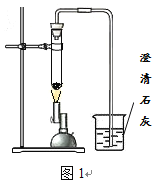
【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
![]() 铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁。铁的氧化物及其部分性质如下:
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁。铁的氧化物及其部分性质如下:
![]() 为红色固体;
为红色固体; ![]() 和
和![]() 均为黑色固体。其中,
均为黑色固体。其中,![]() 具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl ══ 2FeCl3+3HO
Fe3O4+8HCl ══ 2FeCl3+FeCl2+4H2O
FeO+2HCl ══ FeCl2 + H2O
黄色的![]() 溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验
溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验![]() ;
;![]() 溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
【猜想】固体X可能含有:①![]() ②
②![]() ③
③![]() ④ ⑤
④ ⑤![]()
【实施实验】
目的:确定固体X的组成。
步骤 | 操作 | 主要现象 | 结论 |
I | 取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引。 | 部分固体被吸引到磁铁上 | 可能有 |
II | 取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热。 | 固体剧烈燃烧, b中溶液变浑浊 | 一定有 |
III | 另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸。 | 无明显现象 | 一定没有 |
IV | 取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸。 | 产生 。 | 一定有 |
V | 在步骤IV所得溶液中逐滴加入 。 | 溶液不变红色 | 一定没有 |
【反思改进】
同学们讨论发现,用上述实验方法不能确定固体X中一定没有![]() ,理由是 。
,理由是 。

为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
步骤 | 操作 | 数据 |
I | 重新取部分冷却至室温的固体X,称量其质量为m1。 | m1 = 17.9 g |
II | 将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量m3。 | m2 = 317.9 g m3 = 317.3.g |
III | 将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4。 | m4 = 1.1 g |
【获得结论】
(1)为确定固体X中是否含![]() ,m1~m4中应该用到的数据有 。
,m1~m4中应该用到的数据有 。
(2)固体X的成分及质量分别是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com